Nachdem die jahrzehntelangen Bemühungen, die Zahl der Keuchhustenerkrankungen mit flächendeckenden Impfungstrategien substantiell und nachhaltig zu verringern, de facto gescheitert sind (s. hier) und die aktuellen Impfstoffe und -programme vor allem nicht in der Lage sind, die durch Komplikationen einzig realistisch bedrohten jungen Säuglinge vor einer Infektion zu schützen, wird, ausgehend von den angloamerikanischen Ländern, in den letzten Jahren zunehmend eine neue Zielgruppe für die Keuchhustenimpfung ins Auge gefasst: Schwangere.
Die Zahl der Studien, die die Effektivität der Keuchhusten-Impfung in der Schwangerschaft (KiS) untersucht haben ist umgekehrt proportional zu ihrer Qualität und wissenschaftlichen Belastbarkeit: da Keuchhusten bei Säuglingen in den ersten zwei Lebensmonaten (der eigentlichen Zielgruppe der Impfstrategie) eine sehr seltene Erkrankung ist, errechnen und modellieren mittlerweile zahllose reine Beobachtungsstudien (die schwächste Form medizinischer Studien) aus zum Glück sehr kleinen Erkankungszahlen auf den ersten Blick eindrucksvolle Impfstoff-Effektivitäten, die ja - wie immer - nur relative Risikoverringerungen ausdrücken (s. dazu hier). Das absolute Risiko junger Säuglinge an Keuchhusten zu erkranken ist mit und ohne Keuchhusten-Impfung der Mutter in der Schwangerschaft gering.
Eine systematische Übersichtsarbeit konnte noch 2023 keine einzige aussagekräftige randomisiert-kontrollierte Studie (der Goldstandard für Wirksamkeitsstudien) zur Effektivität dieser Impfstrategie identifizieren (de Bruin 2023). Eine andere systematische Literaturübersicht, an der zwei damalige STIKO-Mitglieder mitwirkten, musste nach systematischer Bewertung der Datenlage deren überwiegend völlig unzureichende Qualität einräumen: sowohl zu Wirksamkeit, als auch zu Sicherheit der KiS wiesen die meisten untersuchten Studien ernste bis sehr ernste Risiken für systematische Ergebnis-Verzerrungen auf und die Qualität der Evidenz war "niedrig bis sehr niedrig" (Vygen-Bonnet 2020). Zusätzlich belastet werden diese Studien (auch die letztgenannte), weil fast immer zumindest ein Teil der Studienautoren relevante Interessenkonflikte mit Impfstoffherstellern deklarieren.
(Ein interessanter Nebenaspekt einer der größten untersuchten Studien (Baxter 2017) war der erneute Nachweis, dass die Impfung der Mutter nach der Entbindung ("Kokon-Strategie", wie unverändert von der STIKO empfohlen) keinen messbaren Schutz vermittelt). In einer immunologischen Arbeit aus dem Jahr 2023 heißt es lapidar: "For the cocooning strategy to be effective, the aP vaccine would have to generate sterilizing herd immunity, preventing Bp colonization in close contacts of vulnerable infants. This is not possible with the current aP vaccine." (Callender 2023)
Eine Metaanalyse der bis 2017 vorliegenden Daten durch unabhängige Autoren ohne Interessenkonflikte kommt Ende 2017 zu dem Ergebnis, dass die Impfung in der der Schwangerschaft zwar zweifelsohne zu deutlich erhöhten mütterlichen und kindlichen Antikörper-Spiegeln gegen Keuchhusten nach entsprechender Impfung führt, weist jedoch darauf hin, dass "there is a lack of robust evidence to suggest whether these increased antibodies can also reduce the incidence of pertussis and pertussis-related severe complications or mortality in infants" (Furuta 2017).
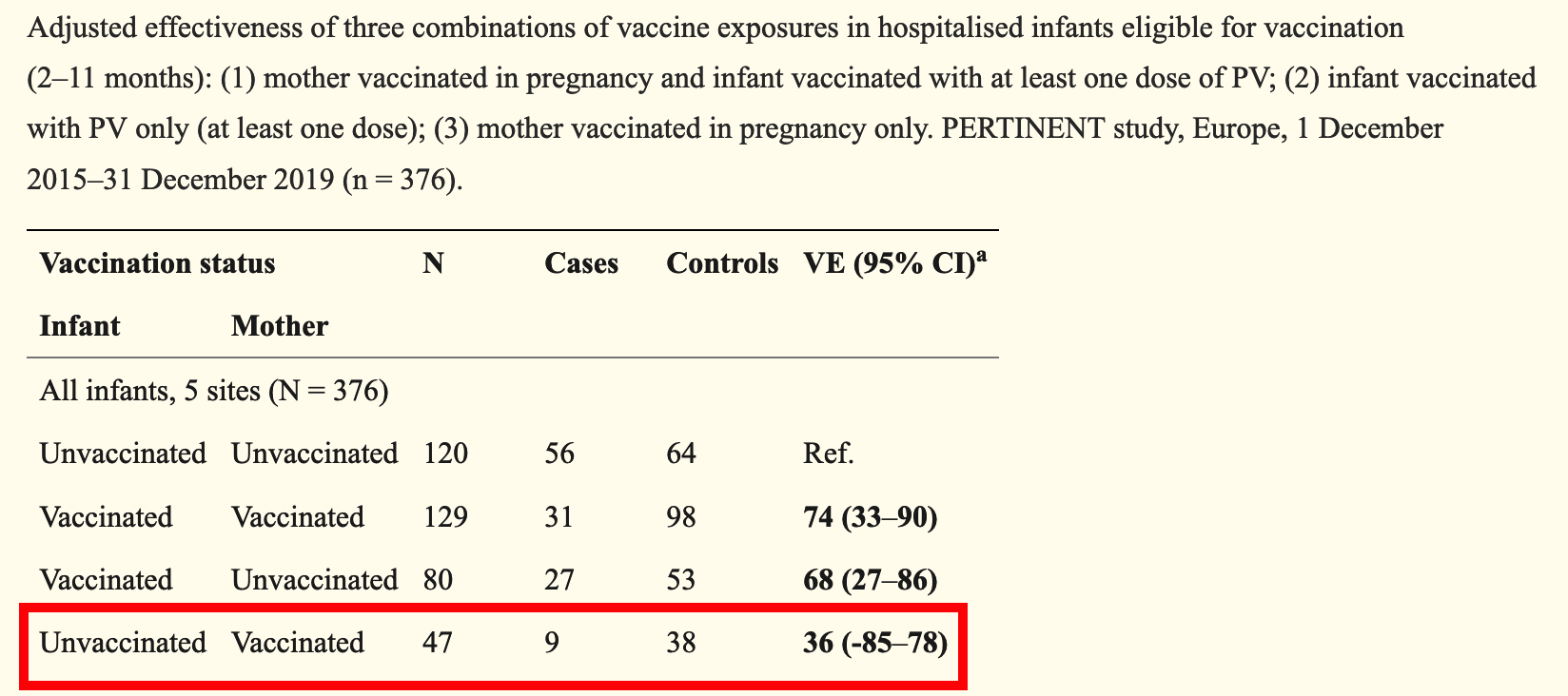
Eine detailliertere Betrachtung verdient eine im Herbst 2022 erschienene Multicenter-Studie des europäische Netzwerks PERTINENT (Merdrignac 2022), bei dem angeschlossene Krankenhäuser in verschiedenen Ländern aktiv nach Keuchhusten-Infektionen bei Neugeborenen und Säuglingen suchen. Die veröffentlichte Studie im Test-Negativ-Design analysiert die Daten von 2015 - 2019 und umfasste 829 Säuglinge, die mit Keuchhusten-ähnlichen Symptomen vorgestellt wurden und unterschied zwischen Säuglingen in den ersten beiden Lebensmonaten, die noch zu jung für eine eigene primäre Impfung waren und solchen im Alter zwischen 2 und 11 Lebensmonaten, die teilweise schon selber geimpft waren (primary vaccination - PV).
Für die sehr jungen Säuglinge fand sich eine relative Risikoreduktion (Vakzin-Effektivität VE) für eine Keuchhusten-Infektion durch die Impfung der Mutter in der Schwangerschaft von etwa 75% - die großen Vertrauensbereiche der Studie (95% KI von 35 - 91%) sind den geringen Fallzahlen geschuldet und schränken die wissenschaftliche Belastbarkeit der Ergebnisse erheblich ein.
Bei Säuglingen ab dem Alter von 2 Monaten wurden 75% mit einem vergleichbaren Vertraunsbereich nur für die Kombination aus eigener und mütterlicher Impfung erreicht. Rein rechnerisch ergab sich für die ausschließliche Impfung der Mutter eine VE von 38%, die allerdings durch den weit in den negativen Bereich reichenden Vertrauensbereich ad absurdum geführt wird.
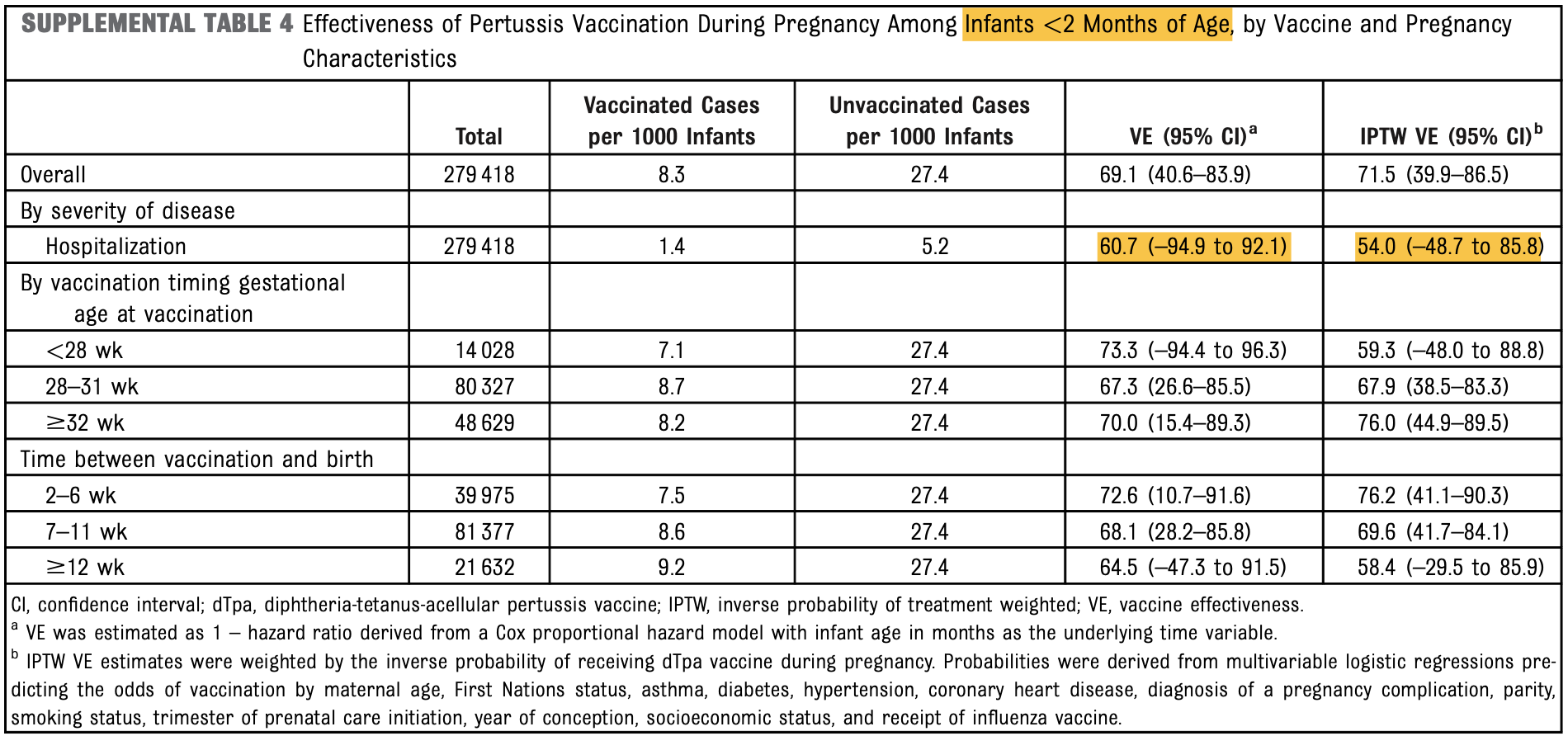
Eine sehr große Kohortenstudie (N=280.000), die auf den Daten einer australischen Mutter/Kind-Datenbank beruht (Regan 2023), errechnete bei annähernd gleicher Zahl geimpfter und ungeimpfter Schwangerer ebenfalls eine allenfalls mäßige Impfstoff-Effektivität für die ersten zwei Lebensmonate von 69,1% (Vertrauensbereich mit 40,6 - 83,9% eher groß), die bis zum Alter von sieben bis acht Monaten deutlich unter 50% sank (43,3%, mit absurd großem VB von 6,8 - 65,6%, also wissenschaftlich nicht wirklich aussagekräftig).
Tatsächlich fand sich für die Impfstoff-Effektivität der dritten Keuchhusten-Impfung des Säuglings selbst eine signifikante Verringerung der VE ("blunting"), ohne dass diese zu einer sicheren Vermehrung der Keuchhustenerkrankungen in dem Alter führte (der Vertrauensbereich war aufgrund der sehr, sehr geringen Fallzahlen zu groß für eine sicher Aussage).
Die Studie zeigt einmal mehr, dass allen Kassandra-Rufen zum Trotz Keuchhusten-Erkrankungen bei Säuglingen, geschweige denn in den ersten Lebenswochen, insgesamt selten sind:
bei 280.000 untersuchten Säuglingen traten innerhalb der ersten 18 Lebensmonate 331 Fälle auf, davon 119 bei Kindern von in der Schwangerschaft geimpften Müttern. In den als besonders kritisch angesehenen ersten zwei Lebensmonaten waren es 49 Fälle, in den ersten 6 Lebensmonaten 124, wobei hier bedacht werden muss, dass spätestens ab dem vierten Lebensmonat ein Schutz des Säuglings selbst durch eine eigene Impfung möglich ist (2. Impfdosis) (Die Studie verschweigt hier die absoluten Zahlen von Kindern geimpfter oder ungeimpfter Mütter).
Ein Schutz vor schweren, eine Krankenhausbehandlung erfordernden Keuchhusten-Verläufen ließ sich trotz der eindrucksvollen Studiengröße weder für die ersten zwei, noch für die ersten sechs Lebensmonate nachweisen - dies ist aber das entscheidene Argument für die Impfung in der Schwangerschaft: Das Risiko, wegen einer Keuchhusten-Erkrankung stationär behandelt werden zu müssen, war zwar rechnerisch verringert (Impfstoff-Effektivität bis zwei Monate 60,7%), der weit in negative Bereiche hineinragende Vertrauensbereich (-94,9 - 92,1%) führt diese Berechnung aber ad absurdum.
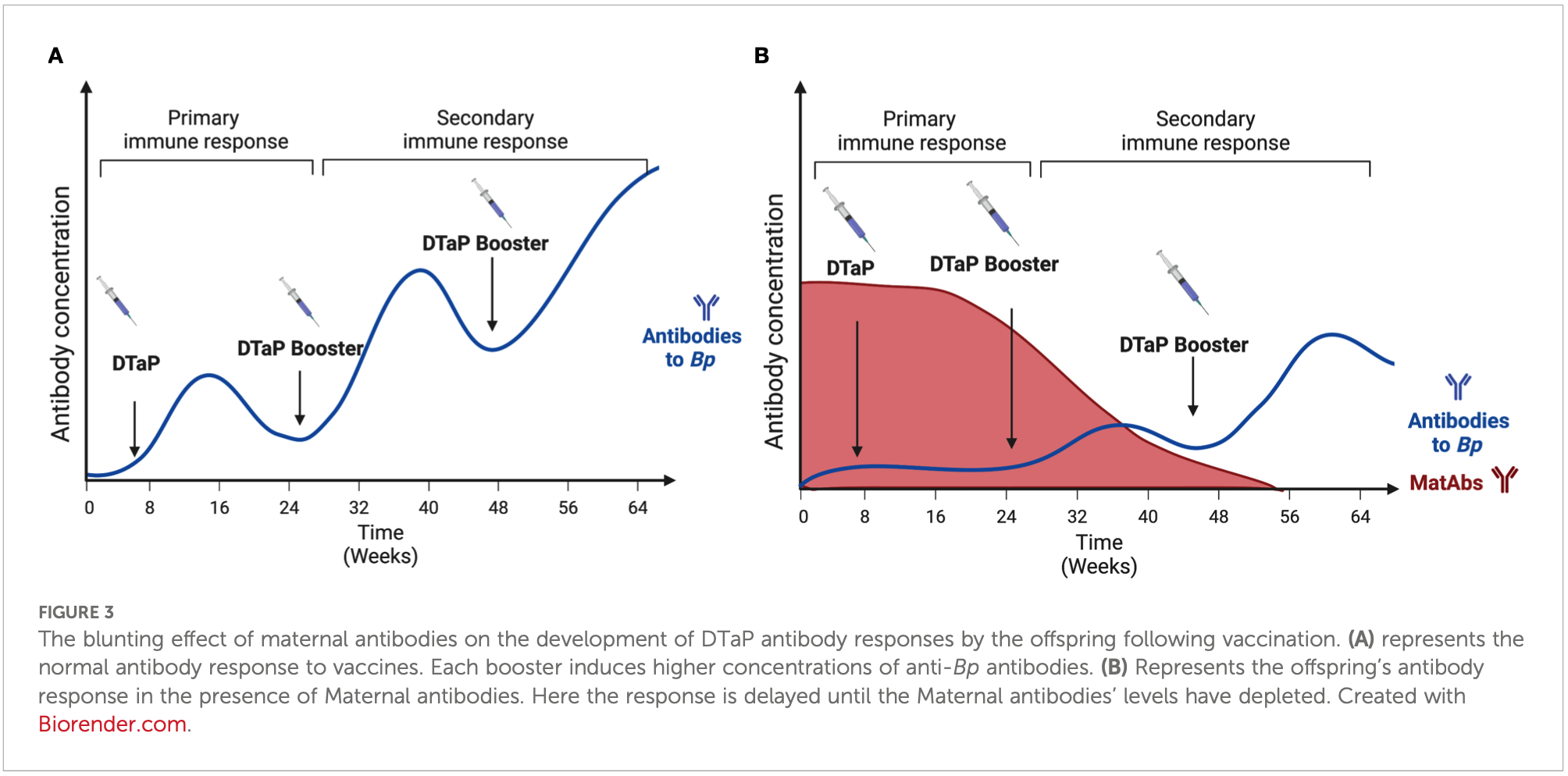 (Callender 2023)
(Callender 2023)
Schon lange ist bekannt, dass die Keuchhusten-Impfung schwangerer Frauen die Wirksamkeit der Keuchhusten-Impfung der dann geborenen Kinder quantitativ und qualitativ abschwächt (so genanntes blunting): die betroffenen Kinder bilden auf die eigene Impfung hin weniger Antikörper (Perrett 2020, Barug 2019, Bento 2017, Hoang 2016, Maertens 2016, Hardy-Fairbanks 2013) und diese sind weniger wirksam gegen Keuchhusten-Bakterien (verringerte Avidität der Antikörper; Caboré 2017). Ebenfalls schon länger bekannt ist, dass dieser Störeffekt nicht nur die Keuchhusten-Impfung selbst, sondern auch andere Säuglingsimpfungen betrifft:
-
Tetanus und Diphtherie (diese werden der Schwangeren gemeinsam mit der Keuchhusten-Impfung verabreicht; Maertens 2016),
-
aber auch z.B. HiB (Wanlapakorn 2020), Kinderlähmung und Pneumokokken (Zimmermann 2019).
Die tatsächliche klinische Bedeutung des blunting - darauf weisen auch die Autoren neuerer entsprechender Studien ausdrücklich hin - ist bis heute unklar (Perrett 2019).
Eine aktuelle (2024) Metaanalyse des Berliner Max Plank Institus für Infektions-Biologie (Briga 2024) untersuchte diesen Effekt jetzt näher und modellierte die mittel- bis langfristigen Auswirkungen dieses bluntings auf die Keuchhusten-Inzidenzen sowohl bei jungen Säuglingen in den ersten zwei Lebensmonaten, als auch für das Alter ab drei Monate:
-
In den ersten Jahren nach der Einführung der Keuchhusten-Impfung Schwangerer kommt es bei jungen Säuglingen zu einem vorübergehend deutlichen Absinken der Erkrankungszahlen ("honeymoon"), das für etwa ein Jahrzehnt anhält, bevor es wieder zu einem deutlichen Wiederanstieg ("rebound") kommt. Da alle veröffentlichten Studien zur Wirksamkeit der mütterlichen Keuchhusten-Impfung derzeit noch den "honeymoon" untersuchen, wird die mittel- und langfristige Wirksamkeit der Impfung Schwangerer nach Ansicht der Autoren wesentlich überschätzt.
-
Bei älteren Säuglingen (≥ 3. Lebenmonat) kommt es durch die Abschwächung der Effektivität der eigenen Impfung von vorne herein zu einem Anstieg der Erkrankungsinzidenz, der umso größer ausfällt, je stärker das blunting ist. Das erhöhte Keuchhustenrisiko von Kindern entsprechend geimpfter Mütter ist noch im Alter von 5 Jahren nachweisbar.
Mittlerweile haben zahlreiche Studien die Sicherheit der Keuchhusten-Impfung in der und für die Schwangerschaft untersucht. Kamen diese in den ersten Jahren überwiegend zu dem Ergebnis, dass es zu keiner Zunahme von Komplikationen während oder unmittelbar nach der Schwangerschaft kam (Kharbanda 2016, Moro 2016, Sukumaran 2015), liegen mittlerweile mehrere Studien vor, die ein erhöhtes Risiko einer so genannten Chorioamnionitis nachweisen - zuletzt zeigte hier eine große Metaanalyse ein um fast 30% erhöhtes Risiko nach der Pertussisimpfung in der Schwangerschaft (Andersen 2021, Vygen-Bonett 2020, Khandarba 2014). Eine Chorioamnionitis ist eine Infektion der das ungeborene Kind umgebenden Strukturen, des Fruchtwassers und/oder der Plazenta. Diese Risikoerhöhung wird von den Autoren einer der systematischen Übersichtsarbeiten in den Kontext anderer aktueller Forschungsergebnisse gestellt, die auf eine erhöhte Infektionsanfälligkeit nach Nicht-Lebendimpfstoffen (ein solcher ist die KiS) hinweisen (Andersen 2021).
Zusätzlich ist problematisch, dass die Keuchhustenimpfung eben nicht als Einzelimpfung verabreicht wird, sondern in Kombination mit Tetanus- und Diphtherie-Impfstoff und deshalb mit dem Zusatz von Aluminium, einem Wirkverstärker, der "unquestionably neurotoxic" [unzweifelhaft nervenschädigend] (Crisponi 2013) ist. Angesichts des flächendeckenden Einsatzes von Aluminiumverbindungen in modernen Impfstoffen ist schon die Auswirkung parenteral (d.h. mit der Spritze) verabreichten Aluminiums auf das Nerven- und das Immunsystem geborener Kinder erschreckend schlecht untersucht. Über die Auswirkung dieser Substanz auf das Immunsystem, das Nervensystem und die Entwicklung der betroffenen Kinder bei parenteraler Aluminiumexposition vor der Geburt wissen wir: nichts. Keine der die "Sicherheit" der Pertussisimpfung in der Schwangerschaft untersuchenden Studien hatte oder hat diese Fragestellungen zum Ziel. Angesichts der Schwere der Erkrankungen, die in der aktuellen Literatur mit Aluminium in Verbindung gebracht werden, ist es wissenschaftlicher Konsens seit vielen Jahren, die Aluminiumbelastung vor allem bei Schwangeren, Neugeborenen und Säuglingen soweit irgend möglich zu reduzieren (Fanni 2014), auch aus dem Wissen heraus, dass vor allem Neu- und Frühgeborene hier eine besonders hohe Empfindlichkeit für entsprechend toxischen Einflüsse von Aluminium haben (ATSDR 2008, AAP 1996).
Technisch gesehen ist ein Keuchhusten-Einzelimpfstoff kein Problem - es gab ihn bis vor einigen Jahren, bis der Hersteller ihn aus wirtschaftlichen Überlegungen vom Markt nahm. Nachdem die STIKO jetzt seit 2020 die Pertussisimpfung in der Schwangerschaft empfiehlt, ist nachdrücklich zu fordern, dass wieder ein Keuchhusten-Einzelimpfstoff ohne Aluminiumzusatz zur Verfügung gestellt wird. Sonst stehen werdende Eltern vor dem Dilemma, den (geringen, s.o.) Schutz ihres Neugeborenen gegen Keuchhusten zu erkaufen um den Preis des derzeit völlig unkalkulierbaren Risikos der Aluminiumexposition ihres ungeborenen Kindes.
In jedem Falle sind zeitnahe Langzeitstudien zu fordern, die die gesundheitliche Entwicklung derjenigen Kinder untersuchen, die dieser neuen Qualität von Eingriff ausgesetzt sind - wobei solche Studien für die nach der Geburt geimpften Kinder auch erst seit einigen wenigen Jahrzehnten ergebnislos gefordert werden ...
Und was aus der Impfempfehlung wird, wenn demnächst dann Keuchhusten-Lebendimpfstoffe auf den Markt kommen? Mehrere verschiedene Präparate sind mittlerweile in der klinischen Erprobung (Locht 2016) ... Auf der einen Seite enthalten Lebendimpfstoffe kein Aluminium, auf der anderen sind Lebendimpfungen in der Schwangerschaft nach heutigem Kenntnisstand ein Tabu - aber das waren bis vor ganz kurzem Impfungen in der Schwangerschaft ja insgesamt....
2018 versuchte eine sehr große Untersuchung (Sukumaran 2018), Licht auf die Frage nach der Sicherheit der Impfung auch über die unmittelbare Peripartalperiode hinaus zu werfen:
- Über 400.000 Kinder wurden auf die Fragestellung hin untersucht, ob nach einer Impfung der Mutter in der Schwangerschaft gegen Keuchhusten oder Grippe die Sterblichkeit der Kinder oder die Zahl der Krankenhausaufenthalte während der ersten 6 Lebensmonate erhöht sei. Das Ergebnis beruhigt und beunruhigt zugleich - es gab für beide untersuchte Parameter
keinen statistisch signifikanten Unterschied zwischen Kindern, deren Mütter geimpft wurden und denen, deren Mütter in der Schwangerschaft ungeimpft blieben.
-
Die Autoren der Untersuchung werten das als Beleg für die Sicherheit der Impfung.
-
In genau gleichem Maße beweist diese Untersuchung aber auch deren Nutzlosigkeit - denn: warum sollten sich Mütter während der Schwangerschaft impfen lassen, wenn ihre dann geboren Kinder bezüglich Sterblichkeit und dem Risiko von Krankenhausaufenthalten in keiner Art und Weise profitieren....
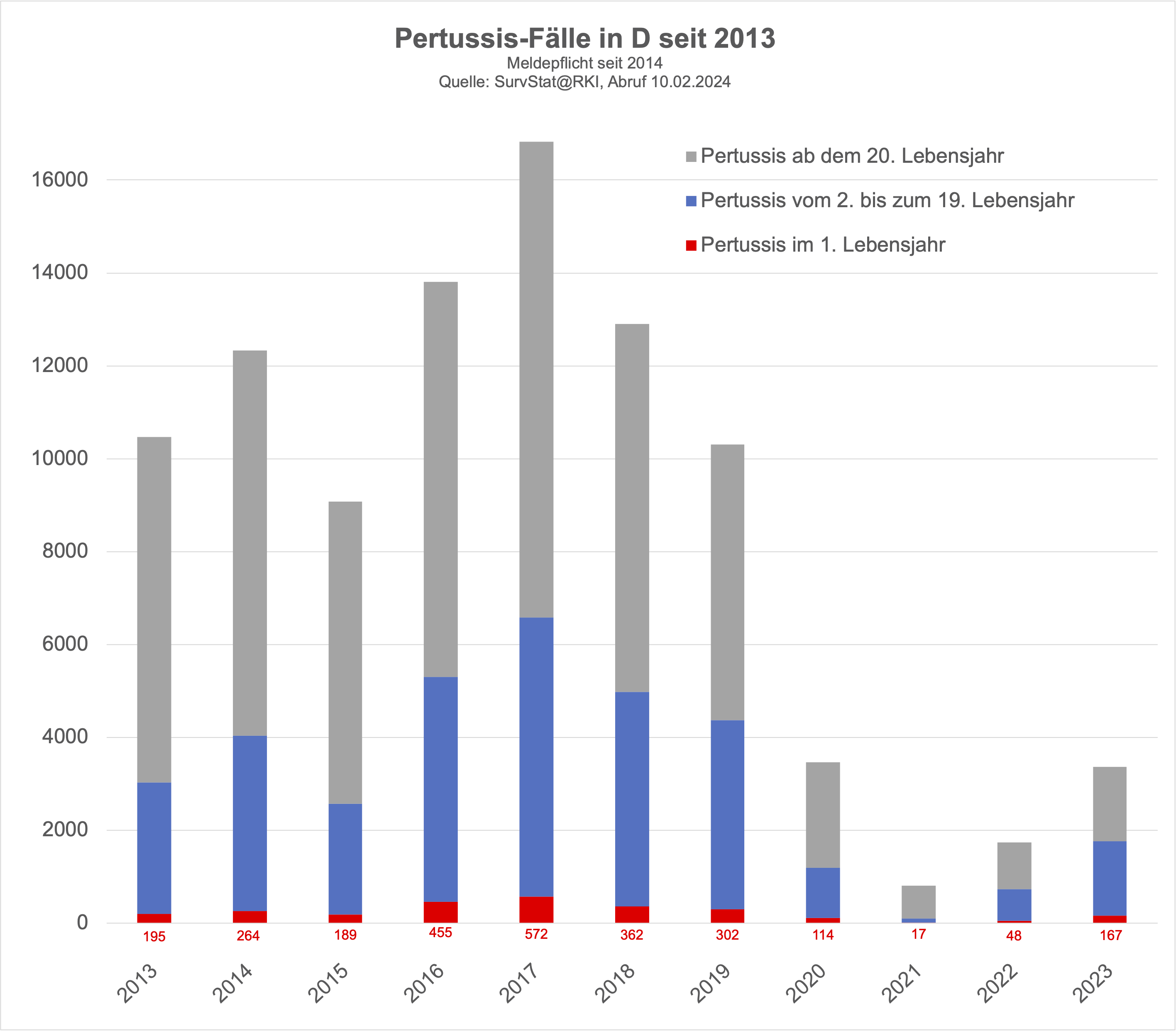
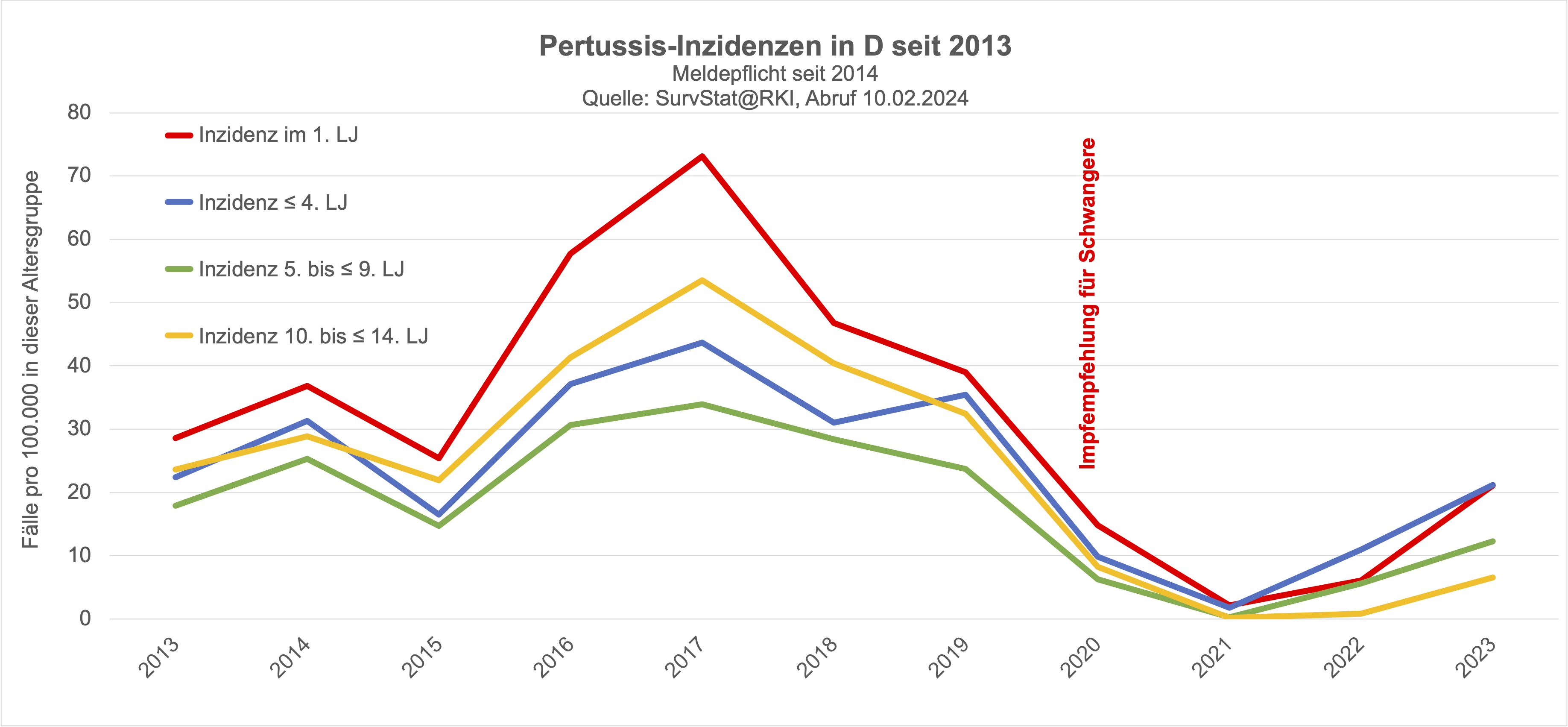
Keuchhusten ist in Deutschland seit 2014 eine meldepflichtige Erkankung, wobei Fachleute von einer Untererfassung der Keuchhusten-Fälle ausgehen (Schielke 2018). Das RKI veröffentlicht die gemeldeten Fälle zwar nach Altersgruppen, für die Betrachtung der Keuchhustenimpfung in der Schwangerschaft ist das verwendete Raster jedoch ungeeignet:
erfasst werden die Fälle im ersten Lebensjahr, relevant wäre jedoch eine Erfassung der Erkrankungen in den ersten zwei Lebensmonaten, in denen die Säuglinge selbst noch nicht geimpft sind und weder die eigene Impfung noch das blunting durch die mütterliche Impfung (die das Erkrankungsrisiko ab dem 3. Lebensmonat ja offenbar erhöht, s.o.) als Störfaktoren wirken.
Dennoch wird klar, dass
-
selbst auf das gesamte erste Lebensjahr bezogen Keuchhusten-Erkrankungen bei Säuglingen in Deutschland selten sind
-
der Verlauf der Inzidenz (also der Fallzahlen pro 100.000 Kinder der betreffenden Altersgruppe) sich bei Säuglingen seit der Einführung der Impfung in der Schwangerschaft nicht grundsätzlich vom Inzidenzverlauf anderer Altersgruppen im Kindesalter unterscheidet.
Es gab in Deutschland von 1998 bis 2022 insgesamt 3 Todesfälle bei Säuglingen im ersten Lebensjahr durch Keuchhusten (gbe-bund.de - Sterbefälle).
AAP. Aluminum toxicity in infants and children. Pediatrics 1996;97;413.
Amirthalingam G. Lancet 2014; 384: 1521–28 . Abruf 14.04.2017
Andersen AR. 2021. Vaccine 25;S0264-410X(21)00166-3. doi: 10.1016/j.vaccine.2021.02.018. Abruf 26.04.2021
ATSDR. Toxicological Profile of Aluminum. Atlanta 2008. Abruf 11.04.2017
Barug D. 2019. Lancet Infect Dis.19(4):392-401. Abruf 09.06.2020
Becker-Dreps S. 2018. American Journal of Preventive Medicine 6/2018. http://dx.doi.org/10.1016/j.amepre.2018.04.013. Abruf 27.06.2018
Bento AI. Euro Surveill. 2017;22(15):pii=30510. Abruf 14.04.2017
Baxter R. Pediatrics Volume 139, number 5, May 2017. Abruf 12.04.2017
Briga M. 2024. https://www.nature.com/articles/s41467-024-44943-7
Bruin de O. 2023. BMJ Glob Health 2023;8:e012376. doi:10.1136/ bmjgh-2023-012376
Caboré RN. 2017. https://doi.org/10.1080/21505594.2017.1296998
Callender M. 2023. Front. Immunol. 14:1210580. doi: 10.3389/fimmu.2023.1210580
Crisponi G. BioMol Concepts 2013; 4(1): 77–87
Dabrera G. Clin Infect Dis. 2015 Feb 1;60(3):333-7.
Eberhardt CS. Clin Infect Dis. 2016;62(7):829-36. Abruf 14.04.2017
Englung JA. Pediatrics. 1995 Sep;96(3 Pt 2):580-4. Abruf 14.04.2017
Fanni D. World J Pediatr, Vol 10 No 2 . May 15, 2014
Furuta M. 2017. BMC Pregnancy and Childbirth. 17(1):390. Abruf 14.07.2018
Hardy-Fairbanks AJ. Pediatr Infect Dis J. 2013;32(11):1257-60. Abruf 14.04.2017
Hoang HTT. Vaccine. 2016;34(1):151-9. Abruf 14.04.2017
Kharbanda EO. Vaccine. 2016 Feb 10;34(7):968-73. Abruf 11.04.2017
Kharbanda EO. JAMA. 2014;312(18):1897-1904. Abruf 11.04.2017
Ladhani SN. Clin Infect Dis. 2015;61(11):1637-44. Abruf 14.04.2017
Locht C. Clin Microbiol Infect. 2016 Dec 1;22 Suppl 5:S96-S102. doi: 10.1016/j.cmi.2016.05.029. Abruf 15.04.2017
Maertens K. Vaccine. 2016;34(1):142-50. Abruf 14.04.2017
Merdrignac L. 2022. https://doi.org/10.1016/j.vaccine.2022.09.054
Moro PL. Vaccine 2016;34(20):2349-2353. Abruf 11.04.2017
Perrett K. 2020.https://doi.org/10.1016/j.vaccine.2019.10.104
Regan AK. 2023. https://publications.aap.org/pediatrics/article/doi/10.1542/peds.2023-062664/194349. Abruf 13.10.2023
Van Savage J. J Infect Dis. 1990;161(3):487-92. Abruf 14.04.2017
Schielke A. 2018. Pediatr Infect Dis J. 37(2):119-25
Sukumaran L, McCarthy NL, Kharbanda EO. Pediatrics. 141(2018):e20173310
Sukumaran L. JAMA. 2015;314(15):1581-1587. Abruf 11.04.2017
Vygen-Bonnett S. 2020. https://doi.org/10.1186/s12879-020-4824-3
Wanlapakorn N. 2020. https://doi.org/10.1016/j.vaccine.2020.08.058
Zimmermann P. 2019. EClinicalMedicine. 2019 Jul 26:13:21-30. doi: 10.1016/j.eclinm.2019.06.010.