Impfstoffe werden – wie jedes andere Arzneimittel auch – vor der Zulassung bereits in umfangreichen klinischen Versuchsreihen an freiwilligen Probanden und ausgewählten Patienten erprobt. Dies gewährleistet ein gewisses Maß an Sicherheit, schließt schwere Nebenwirkungen im Einzelfall jedoch keinesfalls aus.
Zum einen können Studien vor der Zulassung von Arzneimitteln nur sehr häufige Nebenwirkungen zuverlässig erfassen - dies gilt natürlich für alle Arzneimittel, nicht nur für Impfstoffe.
Schon für die Erfassung von Unerwünschten Arznei-Wirkungen (UAWs) eines Arzneimittels, die jeden Tausendsten Behandelten betreffen, bedarf es einer Studiengröße (fast 40.000 Teilnehmer), die in der Praxis selten erreicht wird, wie die nachfolgende Übersicht zeigt:
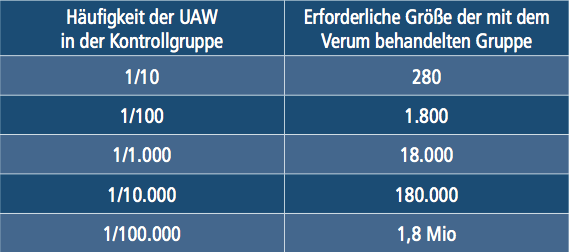 (BFARM 2010a)
(BFARM 2010a)
Ein spezifisches Problem der Impfstoffe ist zusätzlich, dass - anders als bei allen anderen Arzneimitteln - keine Studien im Vergleich zu wirkstofffreien Prüfpräparaten (Placebo) durchgeführt werden, weil es, nach Ansicht der zuständigen Ethikkomissionen, ethisch nicht vertretbar wäre, der Kontrollgruppe den Nutzen einer Impfung vorzuenthalten. Geimpfte Kinder werden in diesen Untersuchungen verglichen mit der anderen ebenfalls, nur eben anders, geimpften Kindern. Angesichts der Komplexität moderner Impfstoffe, die außer dem eigentlichen Wirkstoff eine teilweise schwer überschaubare Vielzahl von Begleitstoffen, Konservierungsmitteln, Wirkverstärkern etc. enthalten, wird die zuverlässige Beurteilung, welche eventuell beobachteten Effekte nur dem eigentlichen Impf(wirk)stoff zuzuschreiben sind, außerordentlich erschwert.
Bei der Frage nach Langzeit-UAW besteht ebenfalls das Problem der fehlenden echten Kontrollgruppe (s.o.). Die wenigen existierenden entsprechenden Studien ergeben Hinweise auf problematische Langzeitwirkungen der Impfungen (MacDonald 2008, Farrington 1995), insgesamt ist diese Frage nach dem langfristigen Effekt von Impfungen auf Gesundheit und Lebenserwartung von Individuen und Bevölkerungen bis heute de facto nicht untersucht.
Darüber hinaus zielen viele Studien zu Impfungen, Impfwirkungen und Nebenwirkungen auf das Erfassen so genannter Surrogat-Parameter: Zielpunkt der Studien müssten nicht kurzfristige Ergebnisse wie Erregerhäufigkeiten (Pneumokokkenimpfung) oder gar nur Antikörperspiegel im Blut (Meningokokkenimpfung), sondern die langfristige Gesamtgesundheit der Geimpften sein. Dies wird inzwischen ja auch für andere medikamentöse Therapieverfahren (etwa bei Bluthochdruck, Oestrogensubstitution etc.) gefordert (Mühlhausen 1996) - hier hat man inzwischen längst lernen müssen, dass ein Medikament, das z.B. die gemessene Knochendichte der behandelten Patienten erhöht durchaus zu einer Vermehrung der Knochenbrüche führen, eines, das den Blutdruck in der untersuchten Gruppe senkt trotzdem die Gesamtsterblichkeit an Herzerkrankungen erhöhen kann.
Eine im Rahmen des European Research Program for Improved Vaccine Safety Surveillance (EUSAFEVAC) durchgeführte Metaanalyse über die Qualität der Studien zu MMR-Impfung kommt zu folgendem Ergebnis: „Die Studiengestaltung und die Berichtqualität zu Sicherheitsfragen des MMR-Impfstoffes, sowohl bezogen auf die Zeit vor, als auch auf die nach der Markteinführung, sind völlig unzureichend“ (Jefferson 2003) – und die Studienlage bezüglich der MMR-Impfung ist im Vergleich zu anderen Impfungen nicht die schlechteste...
Am Beispiel der Hepatitis B-Impfung kann Girard nachweisen, dass die „Forschungsergebnisse“ zu Sicherheit dieses Impfstoffes einfachsten Ansprüchen der „Evidenz-basierten Medizin (EBM)“ nicht genügen (s. hierzu Kapitel Hepatitis B), systematisch sicherheitskritische Studienergebnisse ignoriert und positive Resultate unkritisch überbewertet wurden – auch hier gibt es keinerlei plausiblen Grund davon auszugehen, dass dieses prinzipielle Vorgehen seitens der Pharmaindustrie und der Gesundheitsbehörden auf die Hepatitis B-Impfung beschränkt sei... (Girard 2005).
Literatur:
BFARM 2010a. Bulletin zur Arzneimittelsicherheit 2010, Ausgabe 1.
Farrington CP. Lancet 1995; 345:567-569
Girard M. Autoimmunity Reviews 2005, 4: 96-100
Jefferson T. Vaccine 21 (2003) 3954 - 3960
MacDonald K. J Allergy Clin Immunol 2008;121:626-31
Mühlhausen I. Dt. Ärzteblatt 1996; 93: A-3280-3283
