Varizella-zoster-Viren (VZV) gehören zur Familie der Herpesviren - als solche verbleiben sie nach einer Erstinfektion (Windpocken, früher meist im Kindesalter) lebenslang in Nervenknotenpunkten ("Ganglien") des menschlichen Nervensystems.
Bei einer Schwächung des Immunsystems (schwere akute oder bösartige Erkrankung, Alter, stress, ...) kann es zu einer Reaktivierung des Virus kommen.
Es kommt dann einseitig im Bereich eines oder mehrerer benachbarter "Dermatome" (das ist der Hautbereich, der von dem betroffenen Ganglion nervlich versorgt wird) zum Auftreten eines bläschenförmigen Hautausschlags, oft mit Missempfindungen oder Schmerzen.
Der Bläscheninhalt ist ansteckend und kann als Kontaktinfektion bei immun-naiven Menschen Windpocken auslösen.
Komplikationen
-
bei Betroffensein der Hirnnerven Schädigung von Auge oder Ohr
-
anhalten Schmerzzustände über Wochen und Monate ("postherpetische Neuralgie")
-
bakterielle Superinfektion
-
selten zentralnervöse Komplikationen wie Meningoenzephalitis, Hirninfarkte, ...
Ein abgeschwächter Lebendimpfstoff, der "von der STIKO aufgrund der eingeschränkten Wirksamkeit und seiner begrenzten Wirkdauer nicht als Standardimpfung empfohlen" wird (RKI 2020).
Eine ausführliche, allerdings ältere Darstellung findet sich im industrieunabhängigen arznei-telegramm (a-t 2013).
Eine Metaanalyse aus dem Jahr 2022 konnte für besonders gefährdete Patienten mit kompromittiertem Immunsystem keinen signifikanten Vorteil von Zostavax gegenüber Plazebo feststellen (die Fallzahlen waren auch in der Metaanalyse gering) (Xia 2022).
Impfstoff-Technologie
Verimpft wird als Antigen ein rekombinant hergestelltes virales Oberflächen-Glykoprotein E. Als Wirkverstärker wird das liposomale Adjuvans ASO1B eingesetzt, dessen "Adjuvanseffekt... nicht komplett verstanden" ist (Wagner 2019) und dessen "potenzielles Risiko weiterer immunvermittelter Erkrankungen […] in zwei Sicherheitsstudien erfasst [wird], deren Abschluss 2027 erwartet wird." (a-t 2022)
Eine Impfserie besteht aus zwei Impfungen im Abstand von mindestens zwei bis maximal sechs Monaten.
Wirksamkeit
Studien an Teilnehmern im Alter über 50 Jahre fanden eine relative Risikoreduktion für einen Herpes zoster von etwa 90% (Cunningham 2016, Lal 2015), das Risiko einer postherpetischen Neuralgie bei über 80-Jährigen wurde in etwa gleichem Maße reduziert. Die bisher dokumentierte Wirkdauer wird aktuell mit etwa 7 Jahren angenommen (Levin 2023), es kommt allerdings zu einer Abnahme der Wirksamkeit im Laufe dieser Zeit (Boutry 2021).
Analysen zum Verhindern von Komplikationen liegen jenseits der Zulassungsstudien nicht vor, "Für zwei Geimpfte wird im Rahmen der Erfassung schwerwiegender Ereignisse eine postherpetische Neuralgie bzw. ein disseminierter Herpes zoster berichtet." (a-t 2022).
Die Datenlage zur Anwendung des Impfstoffs bei Patienten, die bereits einen HZ erlitten wird vom arznei-telegramm als "unbefriedigend" eingestuft, das a-t rät hier zur Zurückhaltung in der Indikationsstellung (a-t 2022). Eine große US-amerikanische Kohortenstudie fand 2024 ein signifikant erhöhtes Risiko für das Rezidiv eines Herpes zoster bei Geimpften, die vor der Impfung bereits einmal daran erkrankt waren (Walia 2024) - die STIKO erklärt auch diese Menschen ausdrücklich zu einer Zielgruppe der Impfung (RKI 2024).
Im Gegensatz zum Lebendimpfstoff Zostavax® kann Shingrix® auch bei immunkompromittierten Menschen wirksam angewendet werden. Bei der Indikation zur Impfung muss die hier geringere Wirksamkeit gegen das höhere HZ-Risiko auf der Immunschwäche abgewogen werden.
Für die Indikationsausweitung auf Menschen unter 50 Jahre mit erhöhtem HZ-Risiko durch nicht primär immunkompromittierende Grunderkrankungen wie Diabetes mellitus, Asthma, COPD, kardiovaskulären oder Nierenerkrankungen fehlen bis jetzt belastbare Daten zur Wirksamkeit (a-t 2022).
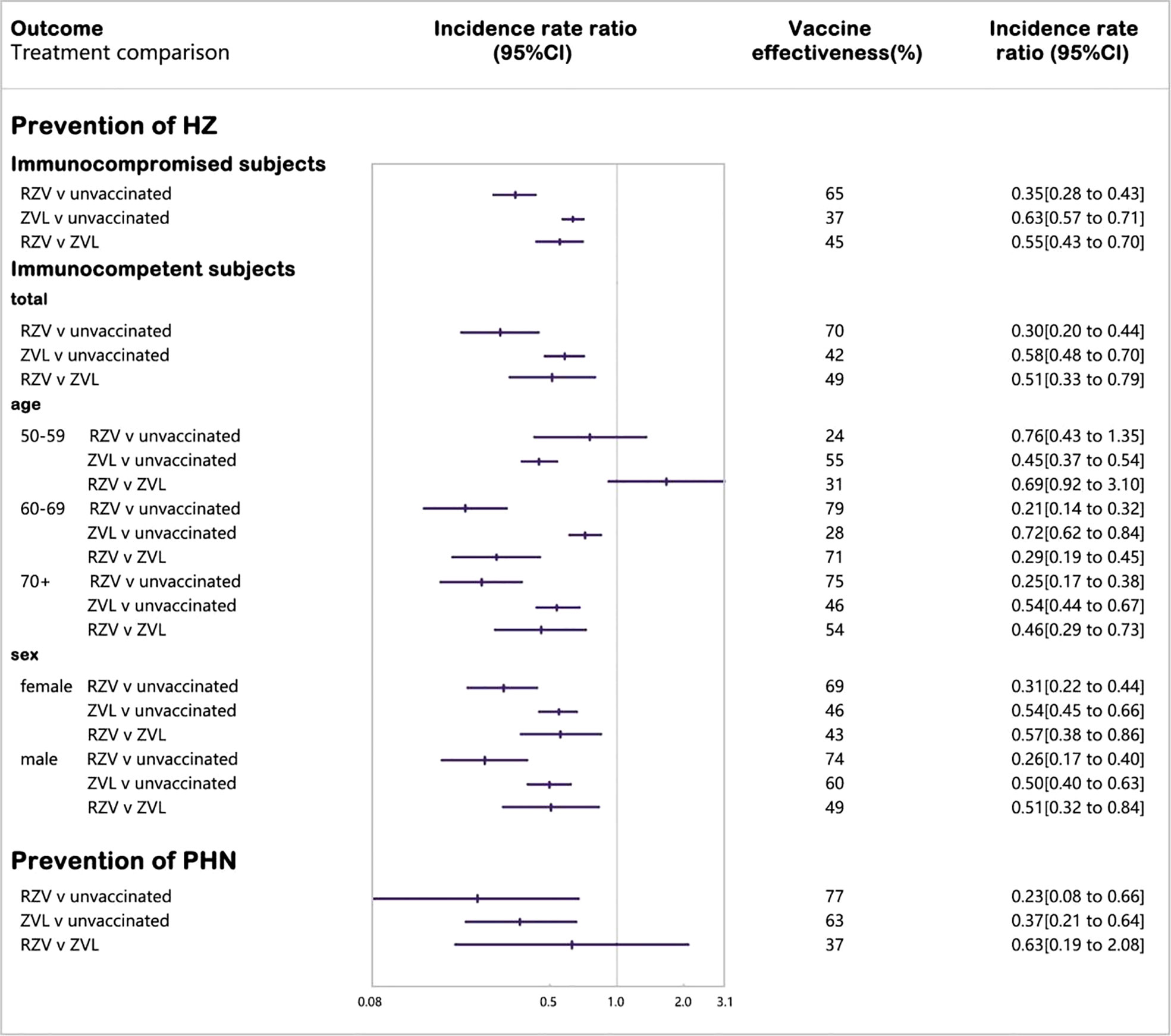
Hier die Angaben zur "real-world"-Effektivität von Shingrix (RZV) und Zostavax (ZVL) im Überblick und im Vergleich zueinander aus einer großen Metaanalyse von 2022 (Xia 2022):
UAW
"Die Impfung mit der rekombinanten Vakzine verursacht sehr häufig unerwünschte Wirkungen. […] Bei über 35% können leichte bis mittelschwere Allgemeinsymptome mehrere Tage andauern." (pharma-kritik 2022) Das arznei-telegramm spricht lapidar von einem "schlecht verträglichen Impfstoff" (a-t 2022)
Herpes zoster (HZ) bzw. zosterartige (blasen- und bläschenförmige) Hauterscheinungen wurden zuerst 2020 der Arzneikommission der deutschen Ärzteschaft vermehrt gemeldet (AkdÄ 2020): "Die Assoziation der Shingrix® Impfung mit dem zeitnahen Auftreten eines HZ ist überraschend, da es sich um eine rekombinante Untereinheiten-Vakzine handelt, die im Gegensatz zu einem Lebendimpfstoff nicht unmittelbar einen HZ hervorrufen kann. Eine gut belegte Erklärung hinsichtlich des pathophysiologischen Mechanismus für das Auftreten von HZ nach Impfung mit Shingrix® gibt es nicht." Daraufhin wurde vom Paul-Ehrlich-Institut eine postmarketing-Studie initiiert, die dieser unklaren Nebenwirkung nachgeht (PEI 2020).
Eine große US-amerikanische Kohortenstudie fand 2024 ein signifikant erhöhtes Risiko für das Rezidiv eines Herpes zoster bei Geimpften, die vor der Impfung bereits einmal daran erkrankt waren (Walia 2024) - die STIKO erklärt auch diese Menschen ausdrücklich zu einer Zielgruppe der Impfung (RKI 2024).
Guillain-Barré-Syndrom: eine große Beobachtungsstudie geht von etwa 3 zusätzlichen Fällen dieser lebensbedrohlichen Lähmungserkrankung pro 1 Million Impfdosen aus (dies entspräche einem Risiko von 1/167.000 für jeden vollständig Geimpften) (Goud 2021).
Eine saudi-arabische Veröffentlichung von 2025 berichtet von 2 Fällen einer schweren autoimmunologischen Hirnentzündung wenige Tage nach der ersten Shingrix®-Dosis (Madani 2025)
Schon seit Jahren wird diskutiert, ob Impfstoffe gegen Gürtelrose - Herpes zoster, das lokalisierte Wiederaufflammen einer früheren Windpockenerkrankung bei Immunschwäche - einen schützenden Effekt gegen Demenzerkrankungen im Alter aufweisen könnten. Bisherige Studien konnten dies jedoch nur auf methodisch mäßiger Datengrundlage für den früher verwendeten Lebendimpfstoff Zostavax™ plausibel machen, der in den meisten Ländern mittlerweile zugunsten des rekombinanten Impfstoffs Shingrix™ verlassen wurde (Näheres s. hier).
Eine große (n = 200.000) Kohortenstudie (Taquet 2024) nutzte jetzt diesen 2017 in den USA innerhalb kurzer Zeit vollzogenen Impfstoff-Wechsel, um diesen fraglichen Schutzeffekt beider Impfstoffe vor Demenz für den Zeitraum von 6 Jahren nach der Impfung zu vergleichen.
Es zeigte sich, dass Shingrix™ 17% mehr demenzfreie Zeit der Geimpften erreichte als Zostavax™ und etwa 25% mehr als nach Verabreichung anderer "seniorentypischer" Impfstoffe (Influenza, Tetanus, ...). Am Ende der 6-jährigen Beobachtungszeit nivellierte sich dieser Effekt jedoch, so dass die Autoren selbst vermuten, es könne gut sein, dass Shingrix™ eher den Beginn einer Demenz (etwas) hinauszögere, als die Erkrankung zu verhindern (The observation that the time-varying HR became greater than 1 towards the end of the follow-up might imply that the vaccine delays rather than prevents dementia onset.).
Die Autoren weisen selbst darauf hin, dass die Studienmethodik eine Aussage über einen kausalen Zusammenhang zwischen Impfung und späterem Auftreten der Demenz nicht erlaube und weiter Forschung hier unerlässlich sei. Denn in jedem Fall bleiben wesentliche Fragen offen:
-
Ist der beobachtete Effekt tatsächlich "nur" ein Hinausschieben des Erkrankungsbeginns, oder wird die Häufigkeit der Demenzerkrankung über die Lebenszeit der Geimpften tatsächlich verringert?
-
Handelt es sich hier um einem spezifischen Impfeffekt durch Schutz vor einer Reaktivierung der schlummernden Windpocken-Viren, oder u.U. um unspezifische Effekte auf das Immunsystem der Geimpften?
Dass gerade Lebendimpstoffe wie Zostavax™ diese meist positiven unspezifischen Effekte aufweisen, weisen Studien z.B. von Peter Aaby oder Christin Stabell-Benn seit langem nach. Und Shingrix™ enthält mit seinem liposomenbasierten Adjuvans AS01 einen Wirkstoffkomplex, der tief in das angeborene Immunsystem eingreift und dies stimuliert (Heineman 2019).
Mittlerweile gibt es zwei weitere Studien, die den Zusammenhang zwischen H. zoster-(Lebend-)Impfung und Demenzentstehung untersuchen. Sowohl in Wales (Eyting 2025), als auch in Australien (Pomirchy 2025) wurde die Impfempfehlung willkürlich an ein bestimmtes Geburtsdatum geknüpft: vorher Geborene erhielten keine H. zoster-Impfung, danach Geborene fielen unter die Impfempfehlung und wurden entsprechend geimpft. In beiden Studien zeigte sich eine deutliche Verringerung der Demenzerkrankungen in den dem Impfbeginn folgenden Jahren bei den Geimpften: in Wales kam es bei einer Nachbeobachtungszeit von sieben Jahren zu einer relativen Risikoverringerung für Demenzerkrankungen von 20% (absoluter Effekt 3,5%), in Australien war der Effekt mit einer absoluten Risikoverringerung von 1,8% allerdings nicht signifikant.
Eine Studie von 2025 (deren einer Autor jedoch massive Interessenkonflikte einräumt) rückt die mögliche Rolle von AS01 in den Fokus: hier reduzierten sowohl der ASO1-haltige Zoster-Impfstoff, als auch der ebenfalls mit ASO1 versetzte RSV-Impfstoff das Risiko einer Demenz-Diagnose für 18 Monate (also eine relativ kurze Nachbeobachtungszeit). Gerade aber diesen ausgeprägten Effekt schon nach so kurzer Zeit werten die Autoren als Argument, dass es kaum der krankheitsverhindernde, sondern eher ein anderen Faktor sein müsse, der diese Risikoverringerung erklärt (Taquet 2025).
AkdÄ. 2020. Fallberichte von Herpes zoster bzw. Zoster-artigen Hautläsionen nach Shingrix® -Impfung („Aus der UAW-Datenbank“). Abruf 20.08.22
arznei-telegramm. NEUE DATEN ZUM VARIZELLA-ZOSTER-TOTIMPFSTOFF SHINGRIX. a-t 2022; 53: 54-4. Abruf 20.08.2022
arznei-telegramm. a-t 2013; 44: 97-8. Abruf 20.08.22
Boutry C. 2021. The Adjuvanted Recombinant Zoster Vaccine Confers Long-term Protection Against Herpes Zoster: Interim
Results of an Extension Study of the Pivotal Phase III Clinical Trials (ZOE-50 and ZOE-70). Clin Infect Dis.
2021 Jul 20:ciab629. doi: 10.1093/cid/ciab629.
Cunningham AL. 2016 Efficacy of the Herpes Zoster Subunit Vaccine in Adults 70 Years of Age or Older. N Engl J Med. 2016 Sep
15;375(11):1019-32. doi: 10.1056/NEJMoa1603800.
Goud R. 2021. Risk of Guillain-Barré Syndrome Following Recombinant Zoster Vaccine in Medicare Beneficiaries. Abruf 20.08.22
Eyting M. 2025. https://doi.org/10.1038/s41586-025-08800-x
Heineman T. 2019. https://doi.org/10.1016/j.coi.2019.02.009.
Lal H. 2015. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med. 2015 May
28;372(22):2087-96. doi: 10.1056/NEJMoa1501184.
Levin MJ. 2023. https://doi.org/10.1007/82_2021_245
Madani TA. 2025. https://doi.org/10.1016/j.jiac.2025.102713
PEI. 2020. Studie zu Shingrix. Abruf 20.08.22
Pomirchy M. 2025. https://doi.org/10.1001/jama.2025.5013
RKI. 2024. https://www.rki.de/SharedDocs/FAQ/Herpes_zoster/FAQ-Liste.html
RKI. 2020. Gürtelrose (Herpes zoster): Antworten auf häufig gestellte Fragen zu Erkrankung und Impfung. Abruf 20.08.22
Taquet M. 2024. https://doi.org/10.1038/s41591-024-03201-5 . Abruf 26.07.2024
Taquet M. 2025. https://doi.org/10.1038/s41541-025-01172-3. Abruf 26.06.2025
Wagner R. 2019. Zusammensetzung und Wirkmechanismen von Adjuvanzien in zugelassenen viralen Impfstoffen. Abruf 20.08.22
Walia A. 2024. JAMA Ophthalmol. 2024;142(3):249-256. doi:10.1001/jamaophthalmol.2023.6830
Xia Y. 2022. https://doi.org/10.3389/fimmu.2022.978203