Hier finden Sie einige grundlegende Überlegungen und Fakten zum Thema Impfen und zu verschiedenen Impfstofftechnologien. [Stand des Artikels 2021, also vor der umfangreichen Anwendung von mRNA-Impfstoffen - der Artikel wird gerade überarbeitet...]
Die Grundlage des Schutzes vor Krankheitserregern wie Viren oder Bakterien ist die so genannte Antigen/Antikörper-Reaktion.
-
Das Antigen ist der Krankheitserreger (bzw. dessen Bestandteile wie z.B. Oberflächenstrukturen) oder von ihm gebildete Giftstoffe. Antigene bestehen in der Regel im Wesentlichen aus Polysacchariden (komplexen Zuckermolekülen) und/oder Proteinen (Eiweissen).
-
Antikörper sind vom Immunsystem gebildete Abwehrmoleküle, die hochspezifisch an dasjenige Antigen binden, zu dessen Abwehr sie gebildet wurden und damit spezielle Abwehrzellen des Geimpften befähigen, dieses potentiell pathogene (krankmachende) Antigen zu eliminieren.
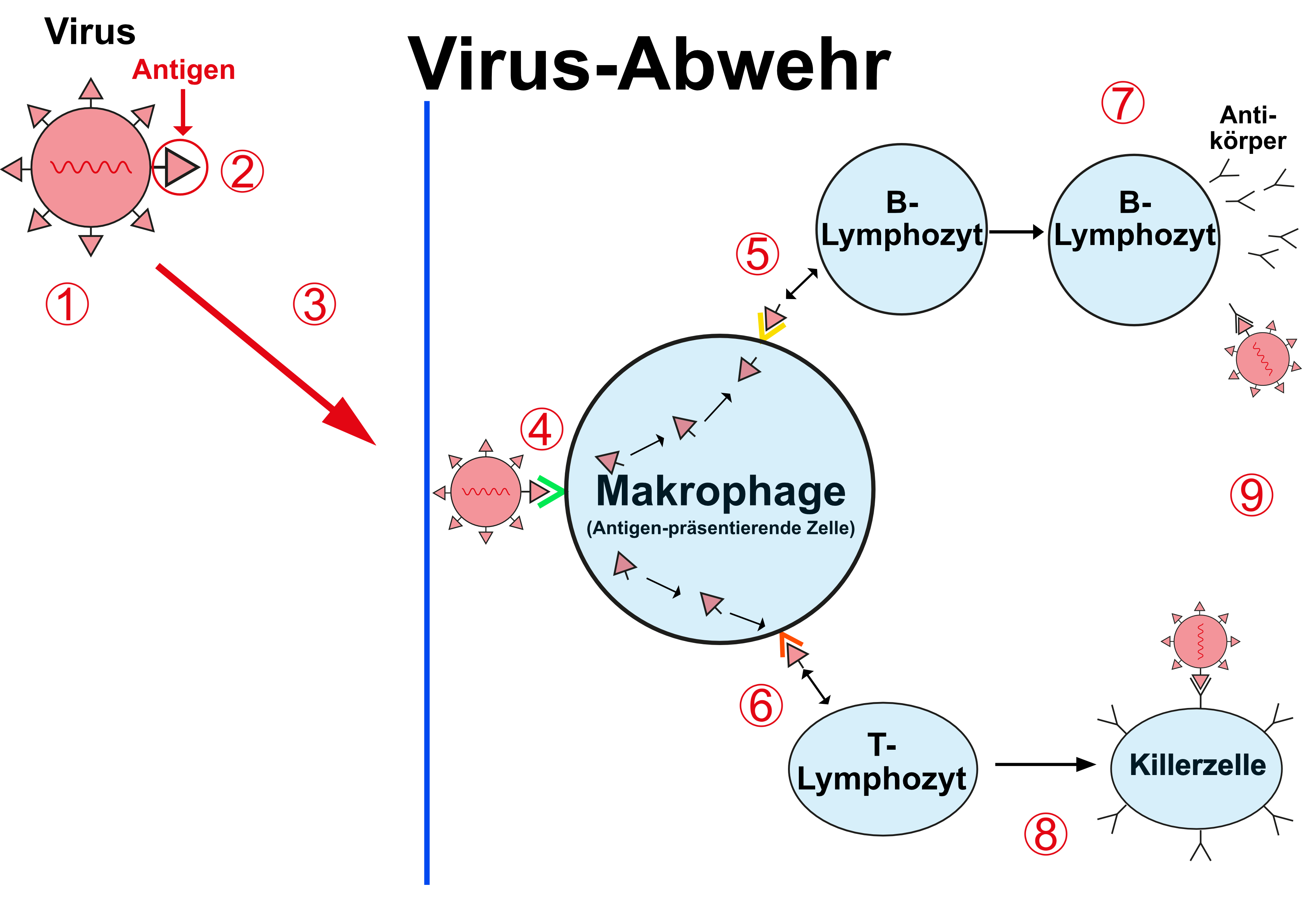
Dringt ein Krankheitserreger, z.B. ein Virus (1) , das ein bestimmtes Antigen (2) trägt, in den Körper ein (3) , wird es zunächst von spezialisierten Zellen (Antigen-präsentierenden Zellen APC, das sind besondere Formen der Makrophagen) erkannt (4) und der körpereigenen Abwehr präsentiert.
Diese besteht dann stark vereinfachend aus zwei Teilen: dem sogenannten humoralen und dem zellulären System:
-
im humoralen System (5) bilden spezielle weiße Blutkörperchen ("B-Lymphozyten", "Plasmazellen") eben diese Antikörper (7) die sich an die Krankheitserreger heften. Diese "Immunkomplexe" werden dann von so genannten Fresszellen (einer anderen Sorte von Makrophagen) eliminiert (9)
-
im zellulären System (6) gibt es ebenfalls spezielle weiße Blutkörperchen ("T-Lymphozyten" (8), die z.B. als Killerzellen antigenspezifisch Krankheitserreger bzw. von diesen befallene Körperzellen binden und der Vernichtung zuführen (9).
Eine Impfung ist das Verabreichen immunologisch wirksamer Substanzen mit dem Ziel, den Körper gegen in der Regel ansteckende Krankheitserreger bzw. deren Giftstoffe zu schützen.
Wir unterscheiden:
-
passive Impfungen - hier werden dem Impfling fertige, von anderen Menschen gebildete Antikörper verabreicht, um einen sofortigen, aber zeitlich sehr befristeten Schutz zu erzielen. Beispiele sind die passive Tetanusimpfung bei verletzten Ungeimpften oder - als Sonderfall - auch die Gabe von z.B. Schlangenserum nach Bissen von Giftschlangen (obwohl dies keine Infektion ist).
-
aktive Impfungen - hier werden dem Impfling die Antigene verabreicht, um sein eigenes Immunsystem anzuregen, selber Antikörper (und mit ihnen ein immunologisches Gedächtnis) zu bilden, was einen längerfristigen, aber eben erst verzögert wirkenden Schutz bedeutet.
Hier werde ich in der nächsten Zeit die verschiedenen Arten und Herstellungsverfahren der für die aktive Immunisierung verwendeten Impfstoffe kurz (und damit natürlich stark vereinfachend!) darstellen - aus gegebenem Anlass werden zunächst die im Moment auch für die Herstellung von COVID-19-Impfstoffen verwendeten, neuartigen Verfahren besprochen werden.
Die Abwehrmechanismen sind grundsätzlich die gleichen wie bei der Virus-Abwehr:
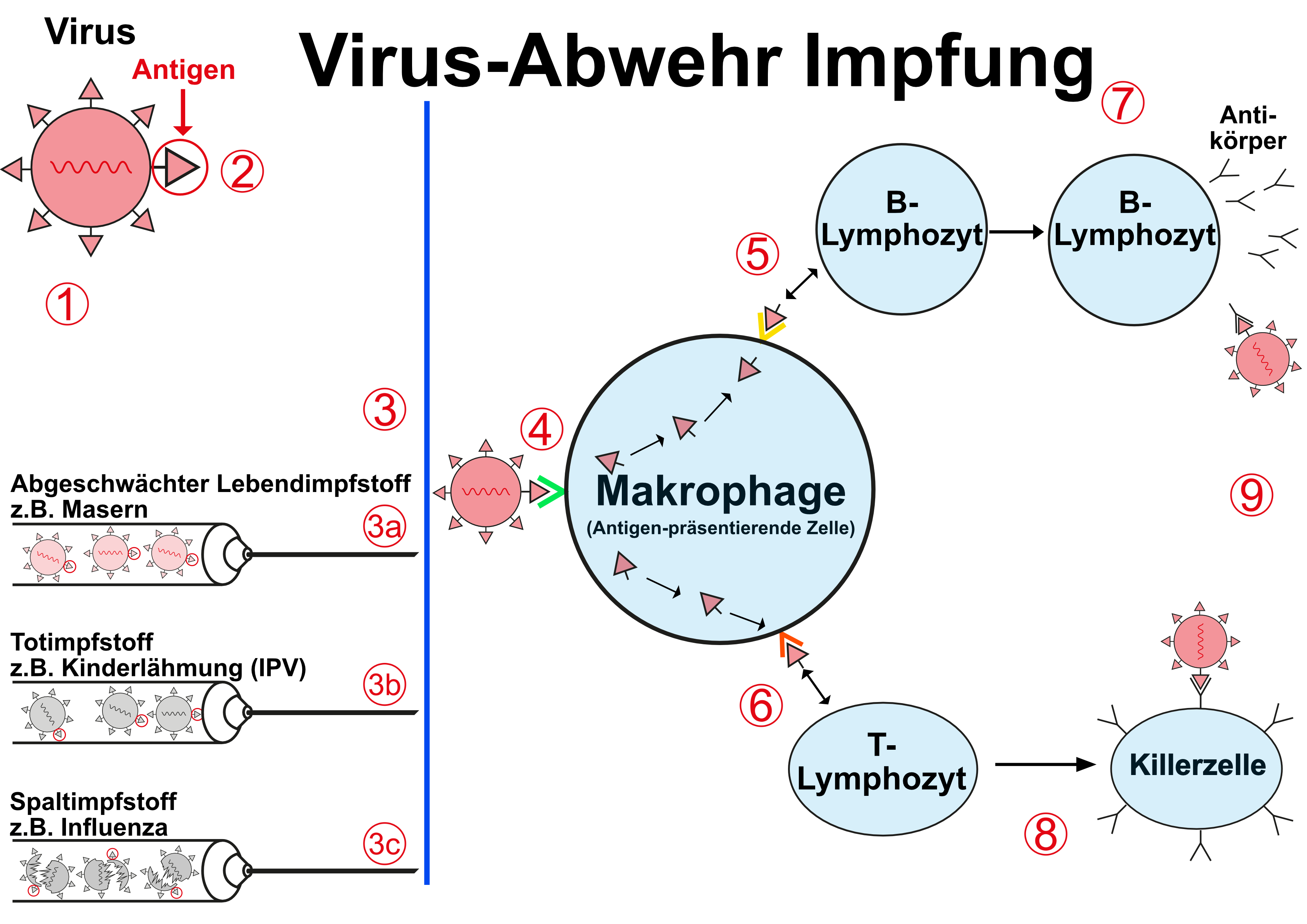
(1) Virus
(2) Antigen
(3) Verarbeitung als Impfstoff, seien es
-
(3a) abgeschwächte Viren, die auf speziellen Zellkulturen gezüchtet werden, von denen sie dann wieder extrahiert und gereinigt werden müssen (Lebendimpfstoffe wie Masern/Mumps/Röteln)
-
(3b) abgetötete Viren (wie z.B. der Polioimpfstoff)
-
(3c) abgetötete und gespaltene Viren (wie z.B. der Grippe-Impfstoff)
-
abgeschwächte Giftstoffe, die aus Kulturen der sie bildenden Bakterien extrahiert werden müssen (Toxoidimpfstoffe wie Tetanus oder Diphtherie)
-
einzelne Bakterienbestandteile, die aus der ganzen Bakterienzelle gezielt gewonnen werden müssen (wie bei Keuchhusten) etc.
(4) Das Antigen wird von Zellen des angeborenen Immunsystems (z.B. Makrophagen) erkannt und
(5) über spezielle Proteinstrukturen (MHCI und MHCII) dem humoralen und dem
(6) zellulären Immunsystem präsentiert.
Hierdurch kommt es zur Bildung
(7) spezifischer Antikörper bzw.
(8) spezifischer Killerzellen, die beide
(9) zur Zerstörung des Krankheitserregers führen.
Speziell für das Verständnis der aktuell diskutierten mRNA-Impfstoffe ist noch ein kurzer Exkurs über die Herstellung von Eiweissstoffen im menschlichen Körper notwendig.
Alle Strukturen und Funktionen lebender Wesen sind wesentlich durch Proteine (Eiweisse) und Proteinverbindungen bedingt und gesteuert - ihre gezielte und kontrollierte Herstellung ist also für jede Form von Leben unabdingbar.
Grundbausteine der Proteine sind so genannte Aminosäuren, die letztendlich zu einer langen Kette aneinandergereiht werden. Bis zu einer Kettenlänge von etwa 100 Aminosäuren spricht man bei dem entstehenden Molekül von einem so genannten Peptid, darüber hinaus von einem Protein. Aufgrund chemischer Anziehungs- und Bindungsverhältnisse werden diese teilweise sehr langen Ketten dann zu komplexen, dreidimensionalen Gebilden gefaltet/verknäuelt.
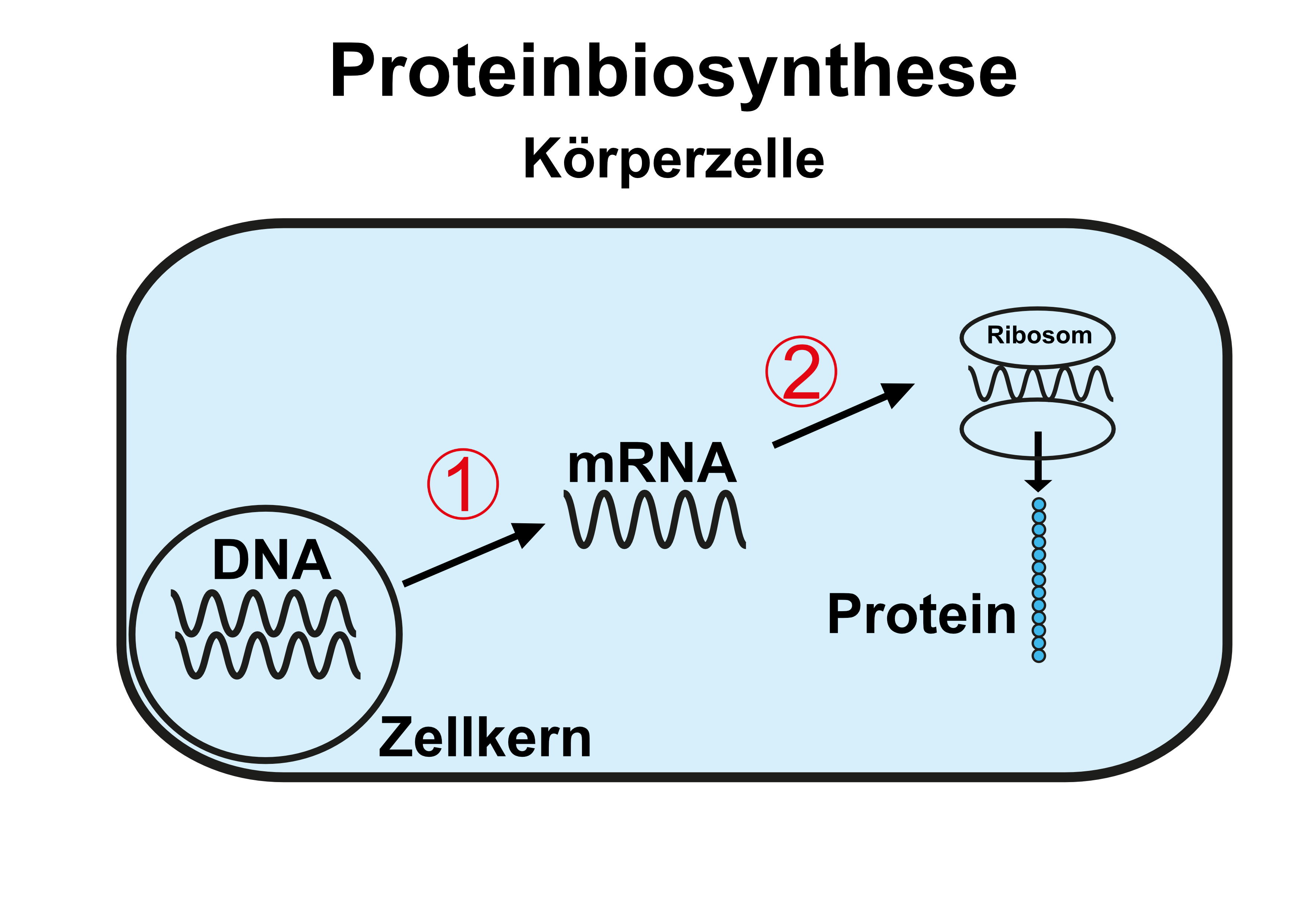
Der genaue Bauplan für diese Proteinsynthese liegt in der Erbinformation eines jeden Lebewesens codiert, beim Menschen in der so genannten DNA, die der wesentliche Bestandteil der so genannten Chromosomen im Zellkern menschlicher Zellen ist.
Um diese Eiweiss-Baupläne jetzt in die die Proteine herstellenden Zellbestandteile (die so genannte Ribosomen) zu transportieren, wird deren Information auf wesentlich kleinere Transport-Moleküle, die so genannte Boten-RNA (englisch messenger-RNA oder mRNA) übertragen (so genannte Transkription (1)). Diese mRNA-Moleküle dienen in den Ribosomen dann als unmittelbare Anweisung für die Synthese hochkomplexer (Körper-)Proteine (so genannte Translation (2)), die nach ihrem Zusammenbau je nach Funktion entweder in der Zelle bleiben, in deren Oberfläche eingebaut werden oder zum weiteren Transport auch aus der Zelle herausgeschleust werden können.
Die Reihenfolge der Eiweissherstellung im Körper ist also: Erbinformation (DNA) > Botenstoff (mRNA) > Eiweiss (Protein).
Diese Reihenfolge und Richtung galt lange Zeit - so lautet wiederum stark vereinfachend das "zentrale Dogma der Proteinbiosynthese" (Crick 1970) - eine Einbahnstraße, was für die Diskussion der Sicherheit von DNA- und mRNA-Impfstoffen von großer Bedeutung ist. Es schien also, und so wird heute in Sicherheitsdiskussionen zu mRNA-Impfstoffen immer noch argumentiert, unmöglich, dass Erbinformation aus einer RNA (wie z.B. dem Impfstoff) in die DNA (wie z.B. die Erbinformation des Geimpften quasi zurückgeschrieben werden könnte.
Spätestens seit HIV weiß man jedoch, dass dies nicht richtig ist: zahlreiche Viren (vor allem so genannte Retroviren wie das HIV), enthalten Enzyme, die sehr wohl aus RNA wieder DNA synthetisieren können, so genannte reverse Transkriptasen (RTs). Und mehr noch: die schlechte Verträglichkeit der ersten HIV-Medikamente, die gezielt diese damals nur bei Viren vermuteten Enzyme hemmen sollten, beruhte auch darauf, dass eben auch menschliche Zellen RTs enthalten (Spektrum, Lexikon der Biologie). Damit ist grundsätzlich auch in menschlichen Zellen der Einbau von (z.B. verimpfter) RNA in die DNA des Impflings nicht auszuschließen.
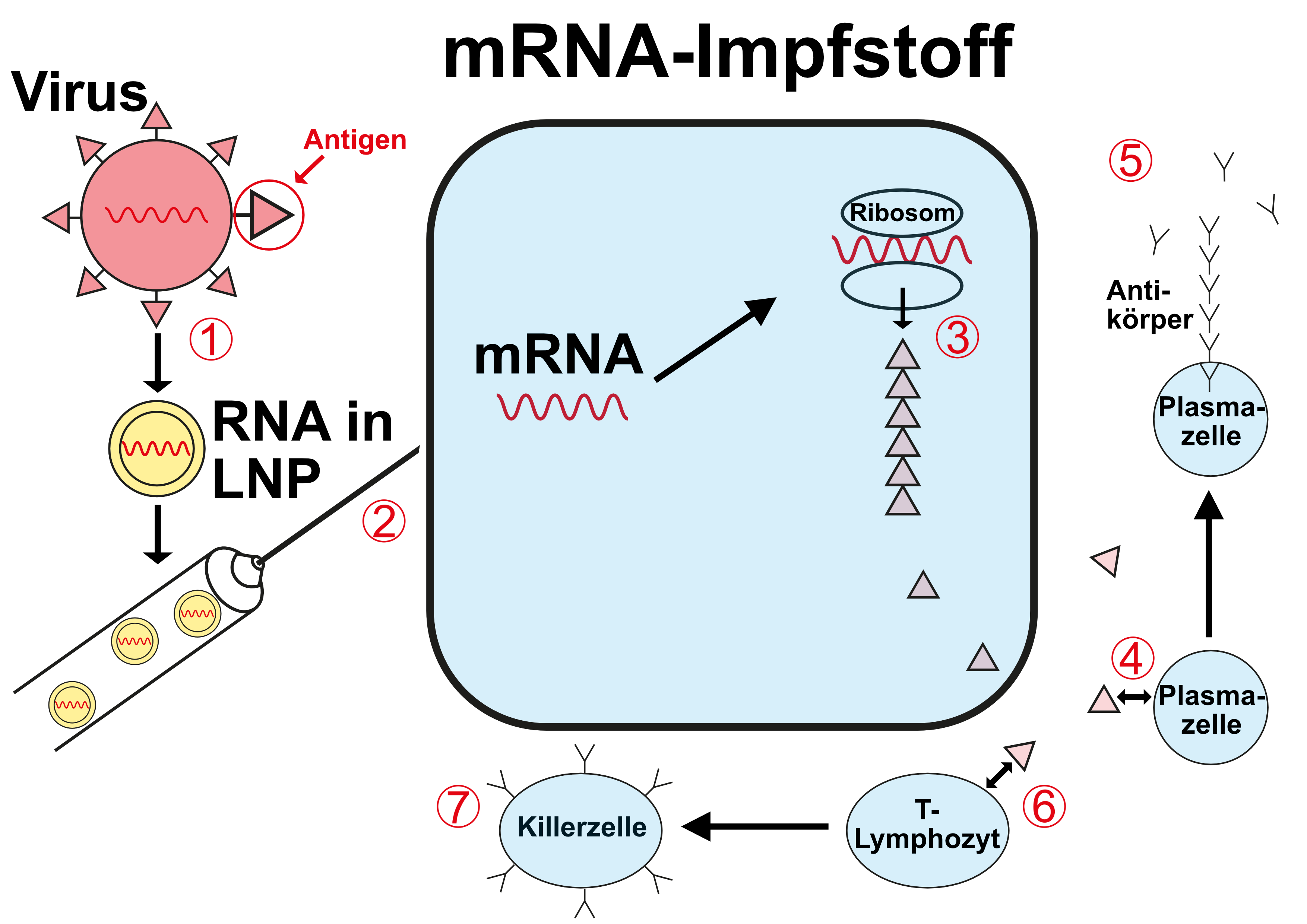
Die eigentlich geniale Idee hinter den mRNA-Impfstoffen ist, zur Herstellung der Antigene, die dann eine Antikörperbildung und damit einen Schutz auslösen, direkt die Eiweissfabriken des Körpers selber, die Ribosomen zu nutzen.
Hierzu schleust man - vereinfachend gesagt - den Bauplan dieser Antigen-Proteine als mRNA direkt in die Zelle, wo er von den Ribosomen gelesen und in die gewünschten Zielproteine umgesetzt wird - ob diese dann in der Zelle verbleiben, an deren Oberfläche eingebaut oder ausgeschieden werden, könne (so hoffte man vor den Erfahrungen mit den Covid-Impfstoffen) über Strukturbestandteile der mRNA direkt gesteuert werden (Maruggi 2019).
(1) Die RNA, die den Bauplan für das gewünschte Antigen enthält wird in so genannte Lipidnanopartikel (LNP) verpackt
(2) Der Impfstoff wird injiziert
(3) Die RNA wird in der Zelle als Bauplan für das gewünschte Antigen benutzt und dieses (ein Protein) wird in den Ribosomen synthetisiert
(4) Das gebildete Antigen bringt Plasmazellen dazu, spezifische Antikörper zu bilden (5) - humorale Immunantwort
(6) Das gebildete Antigen bringt T-Lymphozyten dazu, spezifische Killerzellen zu bilden (7) - zelluläre Immunantwort
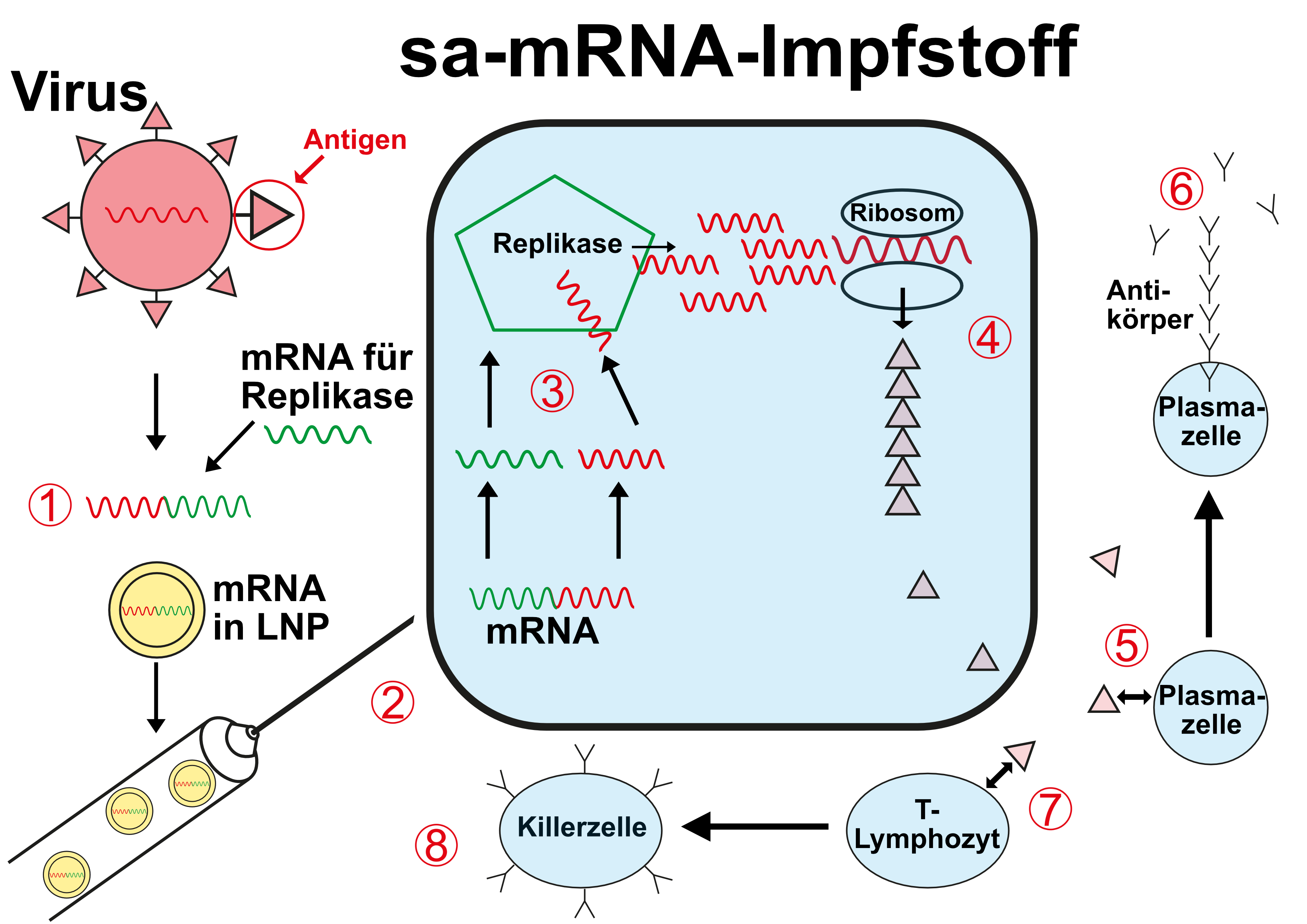
Selbst-amplifizierende (= -kopierende) mRNA-Impfstoffe
Bei der nächsten Generation der mRNA-Impfstoffe wird außer der mRNA für das gewünschte Antigen auch noch die für ein Enzym namens Replikase verimpft. Die Körperzelle des Geimpften baut dann - neben dem Ziel-Antigen - zunächst erst einmal eine Art Kopierer, der die eigentliche mRNA für das Antigen in der Körperzelle vervielfältigt.
(1) Die mRNA, die den Bauplan für das eigentliche, gewünschte Antigen enthält wird verschmolzen mit der mRNA für die Bildung der Replikase und erst dann in so genannte Lipidnanopartikel (LNP) verpackt
(2) Der Impfstoff wird injiziert.
(3) Die Körperzelle synthetisiert die Replikase, die die eigentliche mRNA für das Ziel-Antigen vervielfältigt
(4) Die mRNA wird in der Zelle als Bauplan für das gewünschte Antigen benutzt und dieses wird in den Ribosomen synthetisiert
(5) Das gebildete Antigen bringt Plasmazellen dazu, spezifische Antikörper zu bilden (6) - humorale Immunantwort
(7) Das gebildete Antigen bringt T-Lymphozyten dazu, spezifische Killerzellen zu bilden (8) - zelluläre Immunantwort
Potentielle Vorteile von mRNA-Impfstoffen
-
die Herstellung von mRNA ist mit unvergleichbar geringerem Aufwand verbunden, als die Herstellung der Antigene (s.o.) selber - so wie es eben einfacher ist, einen Bauplan zu zeichnen, als das Haus hinterher zu bauen. Dadurch sind diese Impfstoffe vergleichbar schnell und in großen Mengen herstellbar (Pardi 2018).
-
die Herstellung von mRNA-Impfstoffen verzichtet auf lebende Krankheitserreger oder Zellkulturen, wodurch wesentliche mögliche Sicherheitsprobleme wegfallen
-
bei der Verabreichung von mRNA-Impfstoffen werden (anders als z.B. bei konventionellen Lebendimpfstoffen wie Masernimpfstoffen oder auch bei bestimmten Virusvektor-Impfstoffen) keine vermehrungsfähigen Krankheitserreger verimpft
-
bei der Verabreichung von mRNA-Impfstoffen werde, so behauptete man vor den Erfahrungen mit den Covid-Impfstoffen, keine DNA verimpft, die sich ungewollt in die Erbinformation des Impflings integrieren und diese damit verändern könnte.
-
die "Haltbarkeit" der verimpften mRNA werde - so behauptet man - durch normale intra- und extrazelluläre Abbauprozesse begrenzt (und sei zusätzlich durch strukturelle Merkmale der mRNA steuerbar) (Pardi 2018)
-
anders als Virus-Vektor-Impfstoffe sind mRNA-Impfstoffe grundsätzlich booster-fähig, d.h. sie können theoretisch bei nachlassender Immunität wiederholt geimpft werden.
Potentielle Probleme von mRNA-Impfstoffen
- hier stand zu Beginn der Coronoia ein Text über mögliche Probleme von mRNA-Impfstoffen - alle Warnungen und Befürchtungen haben sich während dieser beispiellosen Massenimpfkampagne erfüllt und/oder wurden bei weitem übertroffen...
Auf die Idee, fremde Zellen als Labor für die Herstellung eigener Proteine zu nutzen (s. mRNA-Impfstoffe), kamen Millionen von Jahren vor den Impfstoffherstellern schon die Viren.
Viren sind so minimalistisch gebaut, dass sie streng genommen nicht zu den Lebewesen gehören: sie bestehen im Wesentlichen aus Erbinformation (1) (entweder RNA oder wie beim Menschen DNA) und einer aus Proteinen und Proteinverbindungen bestehenden Hülle (2), mittels derer sie an Wirtszellen andocken. Die Hüllenstruktur enthält Strukturelemente, die vom Immunsystem des Menschen als Antigen (3) behandelt werden.
RNA-Virus
DNA-Virus
Strukturen, mittels derer sie sich selber fortpflanzen könnten (also z.B. Ribosomen, die Proteine synthetisieren, s.o.) fehlen - Viren nutzen für die Vervielfältigung die Zellstrukturen der infizierten Wirtszelle.
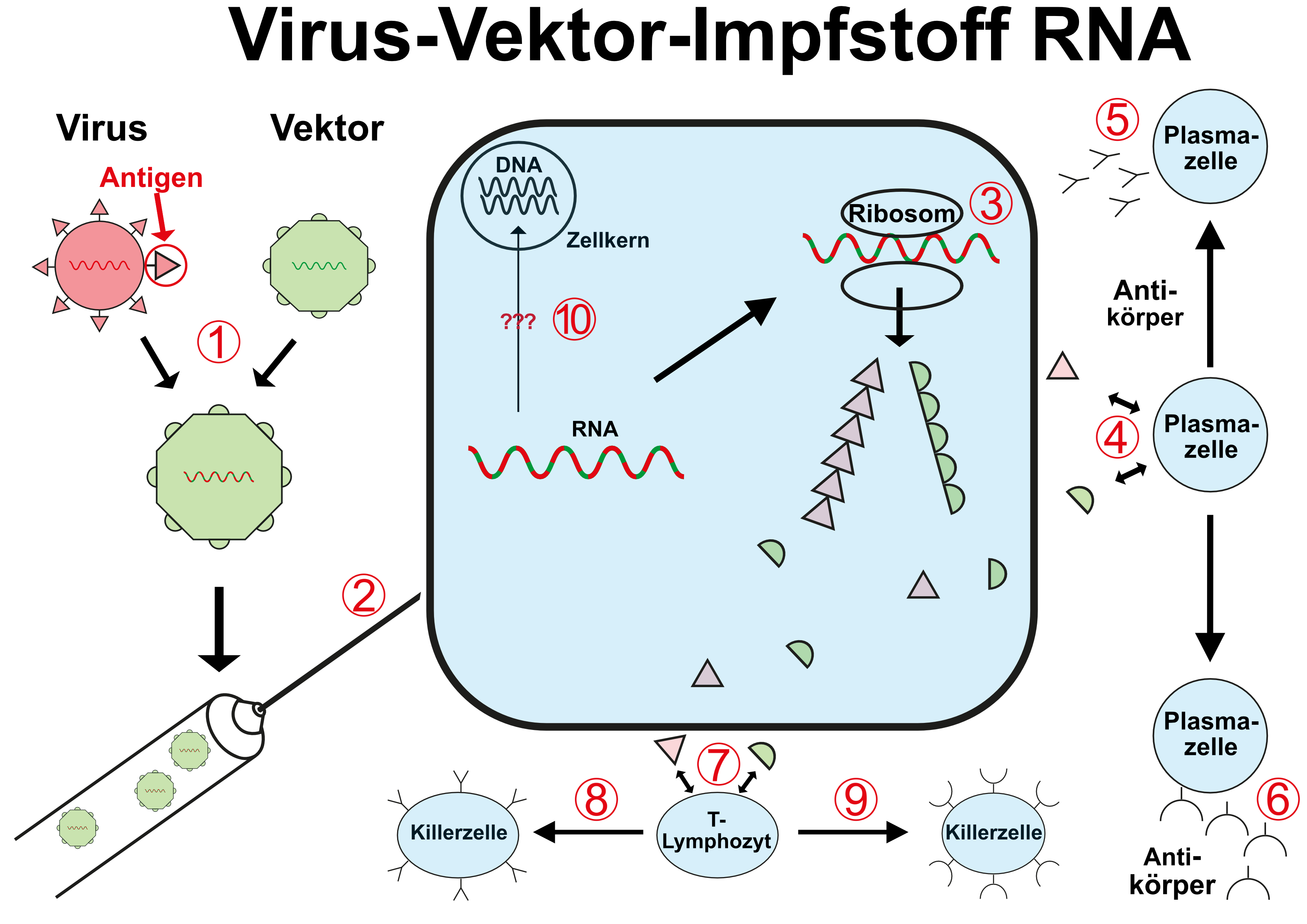
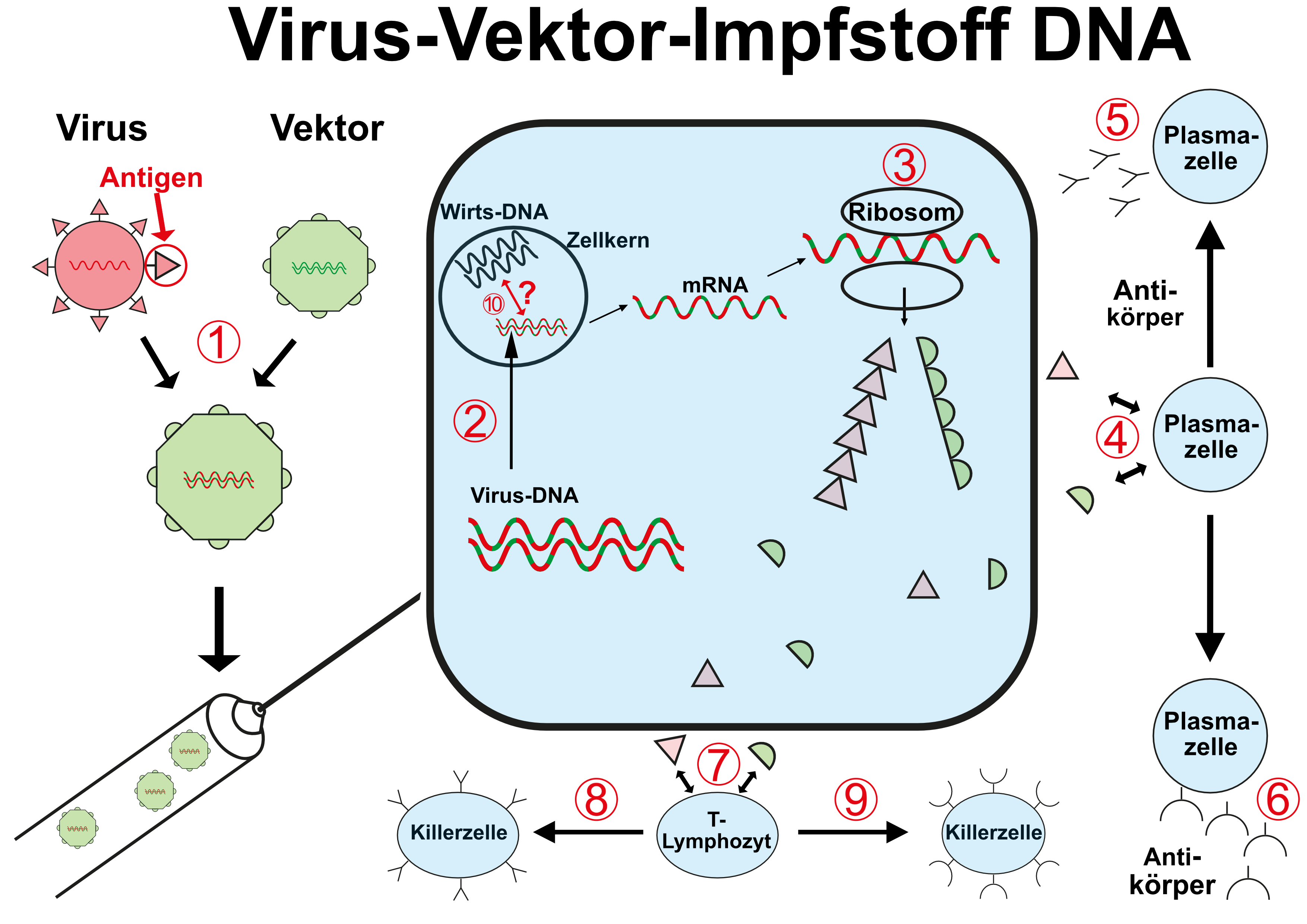
Auch bei Virus-Vektor-Impfstoffen (VVV für viral vector-based vaccine) wird das Ziel-Antigen, das die Immunisierung und damit den Schutz des Impflings vermitteln soll, von dessen eigenen Zellbestandteilen gebildet. Anders als bei mRNA-Impfstoffen wird hier allerdings nicht direkt die Blaupause für die Proteinbiosynthese verimpft, sondern genetisch veränderte Viren.
Die hier verwendeten Viren werden genetisch so verändert, dass einige der Bestandteile ihrer Oberfläche gegen das gewünschte Impf-Antigen ausgetauscht werden. Werden diese Viren dann verimpft und infizieren sie die Wirtszelle, baut diese mit den verimpften Viren dann auch die gewünschten immunogenen Protein-Antigene (die dann wieder in der Zelle verbleiben, in deren Oberfläche eingebaut oder auch von der Zelle ausgeschieden werden können).
(1) In die Erbinformation des Vektor-Virus (grün) wird der Teil der RNA des Ziel-Virus eingebaut, der den Bauplan für das eigentliche Antigen der Impfung enthält
(2) Der genetisch veränderte Vektor-Virus wird verimpft
(3) Die veränderte RNA wird in den Ribosomen in Proteine umgesetzt - es entstehen die gewünschten Antigene, aber auch die des Vektor-Virus (grün)
(4) Beide Antigene führen dazu, dass Plasmazellen spezifische Antikörper bilden - die gewünschten AK (5) und die des Vektor-Virus (6)
(7) Beide Antigene führen dazu, dass sich T-Lymphozyten in spezifische Killerzellen umbilden - in gewünschte (8) und und eigentlich ungewollte (9), die sich gegen den Virus-Vektor richten
(10) Es ist nicht vollständig auszuschließen, dass die verimpfte RNA in die DNA des Zellkerns "zurückgeschrieben" wird ("reverse Transkriptase")
Bei Virus-Vektor-Impfstofffen, die DNA-Vektoren nutzen, ist abweichend von den RNA-Vektoren im Schritt
(2) der Transport der viralen DNA in den Zellkern notwendig, weil nur dort die Umschreibung in mRNA stattfinden kann
(10) das Risiko der Integration der viralen Erbinformation in die des Menschen substantiell, da erstere ja als DNA und im Zellkern der Wirtszelle vorliegt.
Potentielle Vorteile der VVV
-
die bei mRNA-Impfstoffen notwendige, hochkomplizierte Verpackung der mRNA in potentielle problematische (Nano-)Zusatzstoffe entfällt - das verwendete Virus bringt das Impf-Antigen an's Ziel
-
die Antigen-tragenden Viren können so gestaltet werden, dass sie anhaltend von den Zellen hergestellt (repliziert) werden (so genannte replikationskompetente Virus-Vektoren) - dies ermöglicht einen andauernden Impf-Effekt, weil damit auch die Impf-Antigene weiterhin hergestellt werden (Kimpel 2019).
- es wird versucht, die viralen Vektoren so zu konstruieren, dass sie nicht in die Erbinformation der Wirtszelle integriert werden (Kimpel 2019)
Potentielle Probleme der VVV
-
grundsätzlich werden genetisch veränderte infektiöse Erreger verimpft, deren letztendliches und langfristiges Verhalten im Wirtsorganismus (dem Impfling) nicht mit abschließender Sicherheit vorhergesagt werden kann
-
auch der virale Vektor kann als Folge einer spontanen Veränderung seiner Erbinformation (wieder) zum Krankheitserreger werden
-
wenn DNA-Viren als Vektoren verwendet werden, kann nicht abschließend ausgeschlossen werden, dass deren Erbinformation sich in die des Impflings integriert und diese verändert (so genannte Insertionsmutagenese)
-
eines der Hauptprobleme von VVV ist die eventuell vorbestehende oder auch die entstehende Immunität des Wirtsorganismus/Impflings gegen den als Vektor verwendeten Virus. Hier bestehen mehrere Dilemmata: auf der einen Seite ist es sinnvoll, Viren zu verwenden, die in ihrem Verhalten im menschlichen Körper gut bekannt und gut untersucht sind. Dies bedeutet aber, dass viele Menschen gegen diese Viren bereits eine Immunität aufweisen, die zu Immunreaktionen des Körpers gegen den viralen Vektor und nicht primär gegen von diesem getragene das Impf-Antigen führt. Diese Immunität kann dann zu unerwarteten Sicherheitsproblemen führen: so kam es bei einem Teil der mit einem VVV gegen HIV geimpften Probanden zu einer Zunahme der HIV-Infektionen, die man durch eine vorbestehende Vektor-Immunität erklärt (Kimpel 2019). Dieses Problem scheint vor allem an den damals verwendeten Vektor gebunden zu sein, das Ad5-Adenovirus, das aktuell z.B. der russische Impfstoff Sputnik V verwendet (Dingermann 2021, Bushbinder 2020).
-
der Versuch, diese Vektor-Immunität durch die Verwendung von beim Menschen unbedeutenderen Viren zu umgehen (wie beim aktuellen VSV-ZEBOV-Ebola-Impfstoff, der ein vor allem in der Veterinärmedizin bekanntes Virus verwendet) birgt naturgemäß das Risiko, dass mit diesen Viren beim Menschen wenig oder keine langfristigen Erfahrungen bestehen.
-
zusätzlich erschwert wird dieses Problem dadurch, dass die vorbestehende Immunität gegen einzelne virale Vektoren regional extrem unterschiedlich ausgeprägt ist - so zeigen z.B. weniger als 20% der Menschen in Europa und den USA Antikörper gegen das als Vektor verwendete HAdV-26-Virus, in Südafrika sind es dagegen über 90% (Ertl 2016) - dies macht eine üblich globale Verwendung (und Vermarktung...) eines solchen Impfstoffs nahezu unmöglich.
- darüber hinaus ist durch die gegen den Vektor entstehende Immunität auch die Auffrischbarkeit einer VVV ("booster") in Frage gestellt (Kimpel 2019, Pinschewer 2017)
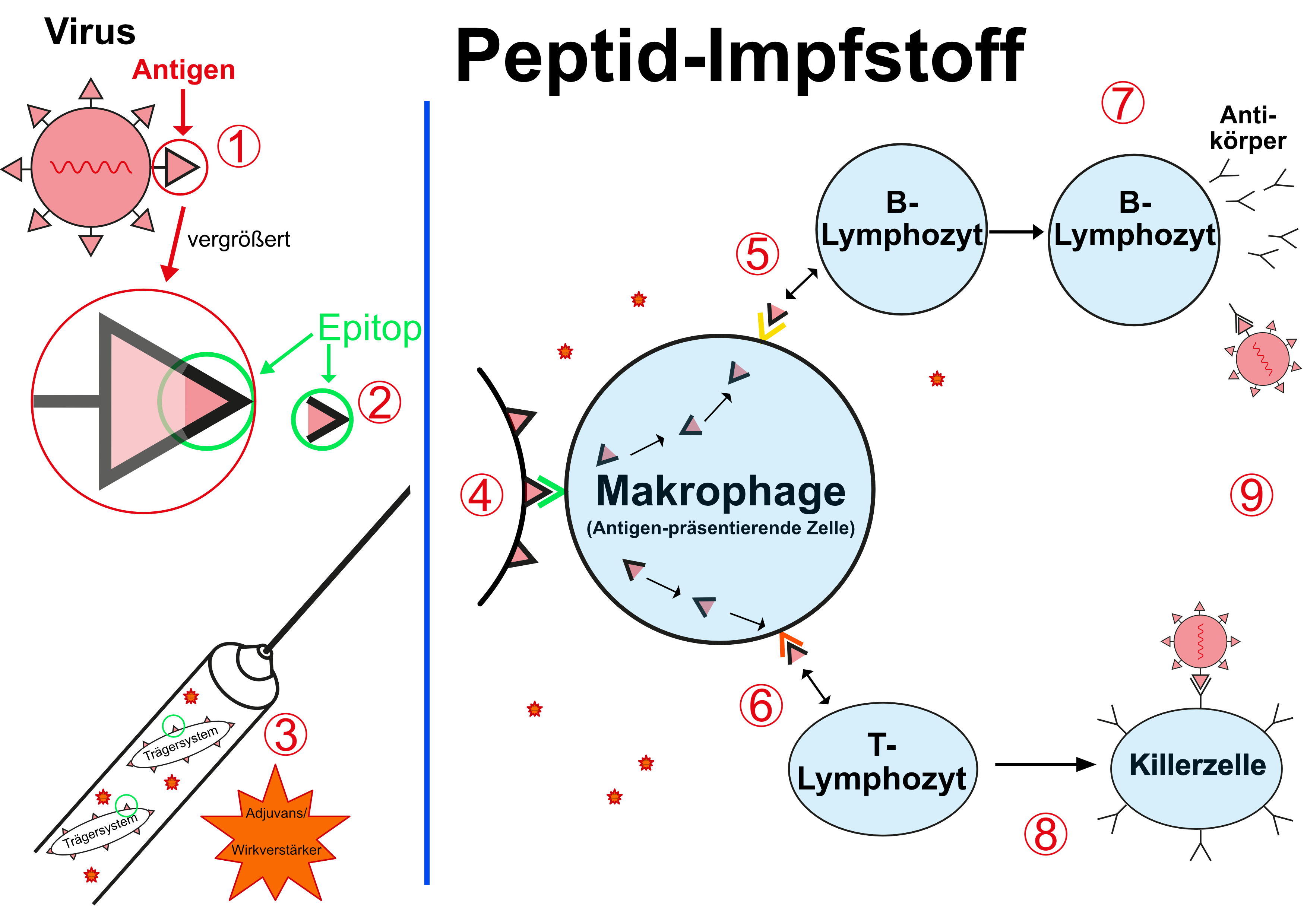
Für das Verständnis der Peptid-Impfstoffe muss die obige Darstellung der Antigen/Antikörper-Reaktion noch etwas verfeinert werden:
so ist es in der Regel nicht der ganze Krankheitserreger oder nicht die gesamte Virusoberfläche, gegen die der Körper Antikörper bildet und mit dem/der diese Antikörper dann reagieren, sondern nur bestimmte, kleine Bestandteile oder Areale, die so genannten Epitope (Spektrum 2001).
Die Grundidee eines Peptid-Impfstoffs ist es letztendlich, nur diese entscheidenden Epitope zu verabreichen, um die gewünschte Immunantwort zu provozieren - diesen Epitopen entsprechen oft Peptide mit einer Länge von nur 20 - 30 Aminosäuren (Marintcheva 2018).
Humorale Immunatwort (B-Zellen)
Hat ein solches Epitop/Peptid Kontakt mit einer B-Zelle, wird diese zu Reifung und Antikörperbildung angeregt - dies vor allem, wenn diese Epitope synchron an verschiedenen Stellen der B-Zelle Kontakt haben ("cross-linking"), wie es bei einer natürlichen Infektion, bei der der Erreger das entsprechende Epitop in der Regel mehrfach präsentiert, der Fall ist.
Da die isolierte Präsentation nur eines Epitops auch nur zu einer schwachen Reaktion führt, werden bei Peptid-Impfstoffen in der Regel mehrere Epitope an einen Träger gebunden. Dies können Nanopartikel sein, oder auch spezielle Eiweisse, die eine verstärkte Immunantwort auslösen. Auch so genannte VLP, virus-like-particles werden als Träger eingesetzt - dies sind Virus-Rudimente, die als Virus nicht infektiös sind, aber als Träger für Epitope dienen können.
Zelluläre Immunantwort (T-Zellen)
Die Präsentation der Epitope vor allem für das zelluläre Immunsystem erfolgt über so genannte APCs, antigen-presenting-cells (ein Teil des so genannten angeborenen Immunsystems) die die Epitope spezifisch binden und an ihrer Oberfläche über bestimmte Eiweißstrukturen (MHC I und II) verankern, so dass sie eine spezifische T-zelluläre Immunreaktion auslösen können (Malonis 2020)
In dieser Möglichkeit der gezielten Stimulation auch des T-Zell-Systems und damit einer zellulären Immunität liegt eine der potentiellen Stärken der Peptid-Impfstoffe.
(1) Oberflächen-Antigen, z.B. eines Virus
(2) hier: vergrößert das eigentlich antigene Epitop
(3) Dies wird auf ein Trägersystem aufgebracht und mit Adjuvantien versetzt verimpft
(4) Das Epitop wird von Zellen des angeborenen Immunsystems (z.B. Makrophagen) erkannt und
(5) über spezielle Proteinstrukturen (MHCI und MHCII) dem humoralen und dem
(6) zellulären Immunsystem präsentiert.
Hierdurch kommt es zur Bildung
(7) spezifischer Antikörper bzw.
(8) spezifischer Killerzellen, die beide
(9) zur Zerstörung des Krankheitserregers führen.
Potentielle Vorteile der Peptid-Impfstoffe
-
Peptid-Impfstoffe werden praktisch ausschließlich auf chemischem Wege synthetisiert - sie sind dadurch (anders als biologisch hergestellte Impfstoffe) klar definierbar und charakterisierbar.
-
Die Herstellung ist einfach, kostengünstig sowie beliebig reproduzierbar.
-
Eine potentielle biologische Kontamination, wie sie bei Impfstoffen aus Zellkulturen nie vollständig auszuschließen ist, spielt hier keine Rolle.
-
Die Impfstoffe sind in der Regel wasserlöslich und unter einfachen Bedingungen zu lagern (keine Kühlkette). Sie können gefriergetrocknet werden.
-
Grundsätzlich ist es möglich, in einer Impfung verschiedene Epitope zu verabreichen.
-
Das Allergierisiko gegen die Epitope (!) selber ist aufgrund ihrer geringen Größe gering (das Risiko wird jedoch durch die notwendigen Begleitstoffe (s.u.) maßgeblich verändert).
- Auch das Risiko einer Autoimmunreaktion durch die Epitope selber ist aus dem gleichen Grund sehr gering (das Risiko wird jedoch durch die notwendigen Begleitstoffe (s.u.) maßgeblich verändert).
Potentielle Probleme der Peptid-Impfstoffe
-
Peptide sind - anders als die komplex gefalteten Proteine - im Körper sehr instabil und werden rasch abgebaut (Skwarczynski 2016). Dies wird z.B. verringert, indem die als Epitop wirksamen Abschnitte in größere Proteine eingebettet werden, die dann aber wieder eigene Nebenwirkungen (Allergien, ...) auslösen können (Skwarczynski 2016).
-
Aufgrund ihrer geringen Größe brauchen die Peptide Trägersysteme (s.o.), an die gebunden sie dem Immunsystem präsentiert werden. Diese Trägersubstanzen (potentiell toxische Nanopartikel, Polymere wie das hochallergene Polyethylenglykol, ...) können für sich spezifische Nebenwirkungen hervorrufen.
-
Für eine ausreichend starke Immunantwort brauchen Peptid-Impfstoffe in der Regel Adjuvantien, also Wirkverstärker (Aluminium, Squalen-haltige Adjuvantien wie das für Narkolepsie verantwortlich gemachte ASO3, ...), die ebenfalls für sich spezifische Nebenwirkungen hervorrufen können.
-
Die Eiweißstrukturen, die in den APCs die Epitope präsentieren sind Teil eines komplexen Systems immunologischer Gewebemerkmale (so genannte HLA-Antigene). Diese sind genetisch und teilweise auch ethnisch determiniert, was eine "universelle Verwendung" der Impfstoffe erschwert.
-
Da die Epitope als antigene Minimallösung nur eine maximal spezifische antigenetische Information liefern, besteht die Gefahr, dass Peptid-Impfstoffe bei bestimmten Erreger-Subtypen oder nach Mutationen des Krankheitserregers nicht (mehr) wirksam sind (Skwarczynski 2016).
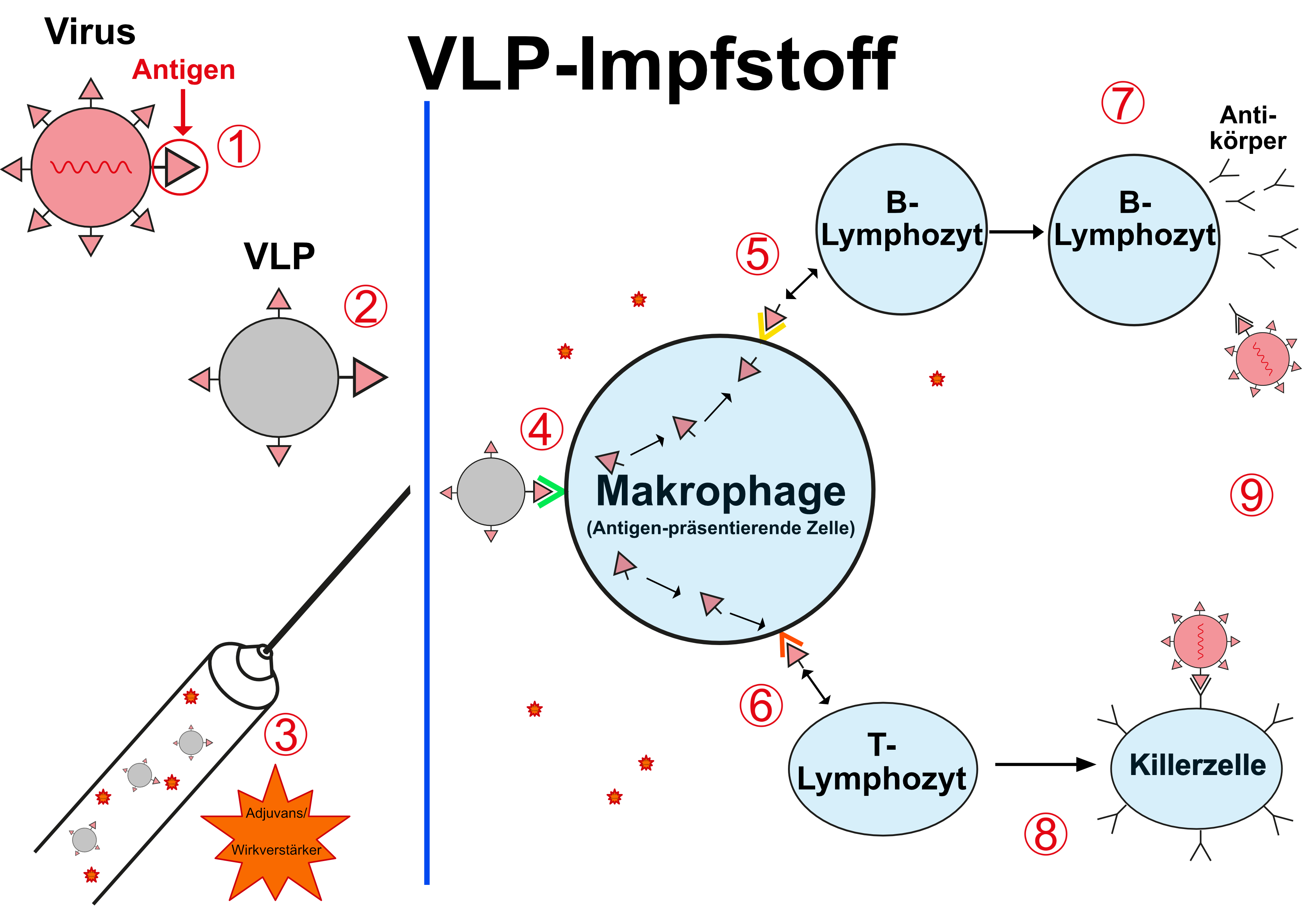
virus-like-particles/VLP sind vereinfacht gesagt Viren ohne Erbinformation und ohne für die Replikation notwendige Steuerproteine - also noch vereinfachender gesagt: die Virushülle mit den darauf befindlichen Antigenen.
Hergestellt werden solche Strukturen, indem entsprechend veränderte virale Erbinformation in andere Zellsysteme eingeschleust wird, die dann diese VLPs synthetisieren - die dafür nutzbaren Zellen sind vielfältig, es können Pflanzenzellen sein (wie bei Medicagos COVID-19-Impfstoffkandidat), aber auch Bakterien, Hefen, Insekten- oder Säugetierzellen.
Diese Technologie wird seit vielen Jahren in der Impfstoffherstellung genutzt - prominente Vertreter sind z.B. der Hepatitis B-Impfstoff Engerix B® oder die Impfstoffe gegen HPV (Cervarix® und Gardasil9®).
(1) Oberflächen-Antigen, z.B. eines Virus
(2) VLP mit diesem Antigen
(3) Zugabe von Adjuvantien
(4) Das Antigen wird von Zellen des angeborenen Immunsystems (z.B. Makrophagen) erkannt und
(5) über spezielle Proteinstrukturen (MHCI und MHCII) dem humoralen und dem
(6) zellulären Immunsystem präsentiert.
Hierdurch kommt es zur Bildung
(7) spezifischer Antikörper bzw.
(8) spezifischer Killerzellen, die beide
(9) zur Zerstörung des Krankheitserregers führen.
Potentielle Vorteile der VLP-Impfstoffe
Die verwendeten Virusstrukturen sind zuverlässig nicht mehr vermehrungs- und infektionsfähig.
Die Antigene sind Teil einer Struktur, die von sich aus bereits eine Größe hat, die vom Immunsystem gut erkannt werden kann.
Es können mehrere gewünschte Antigene gleichzeitig verabreicht werden.
Die Impfstoffe sind booster- und auffrischbar.
In der Regel sind VLP-Impfstoffe unproblematisch lagerfähig.
Potentielle Nachteile der VLP-Impfstoffe
Für eine optimale Immunantwort braucht es in der Regel potentiell problematische Adjuvantien wie z.B. Aluminiumverbindungen (HepB- und HPV-Impfstoffe) oder sogar ASO3 (Medicago-COVID-19-Impfstoffkandidat).
Graphik: Joe Rabe
Alberer M. 2017. The Lancet. 390(10101):1511–20
Bushbinder SP. 2020. Lancet. DOI: https://doi.org/10.1016/S0140-6736(20)32156-5
Crick F. 1970. Nature 227, 561–563 (1970)
Dingermann T. 2021. Adenovirus-5-basierte Impfstoffe und das HIV-Risiko. Pharmazeutische Zeitung 05.03.2021. Abruf 05.03.2021
Ertl HCJ. 2016. Current Opinion in Virology 2016, 21:1–8
Jackson NAC. 2020. npj Vaccines (2020)5:11
Kimpel J. Trillium Immunologie 3/2019. Abruf 04.05.2020
Malonis RJ. 2020. Chem. Rev. 2020, 120, 3210−3229. Abruf 29.01.2021
Marintcheva B. 2018. Harnessing the power of virusses. Abruf 29.01.2021
Maruggi G. 2019. Molecular Therapy. 27(4):757–72
Pardi N. 2020. Current Opinion in Immunology. 65:14–20
Pardi N. 2018. Nature Reviews Drug Discovery. 17(4):261–79
Pinschewer DD. 2017. Swiss Med Wkly. 2017;147:w14465. DOI: https://doi.org/10.4414/smw.2017.14465
Roier S. 2019. Trillium Immunologie 3/2019. Abruf 03.05.2020
Skwarczynski M. 2016. Chem. Sci. 7, 842. Abruf 29.01.2021
Spektrum. 2001. Kompaktlexikon der Biologie. Abruf 29.01.2021
Wadmann M. 2020. https://science.sciencemag.org/content/370/6520/1022.full