In der Auseinandersetzung mit Krankheitserregern oder Impfstoffen bedient sich unser Immunsystem zweier miteinander zwar eng verzahnter, aber doch grundsätzlich unterschiedlicher Systeme: des "humoralen" und des "zellulären" Immunsystems.
Das humorale Immunsystem beschreibt die Fähigkeit bestimmter Abwehrzellen (so genannte B-Zellen), gegen Krankheitserreger bestimmte Eiweißstoffe ("Immunglobuline/Ig" oder "Antikörper/AK") zu bilden, die dann primär im Blut zirkulieren und dort eingedrungene Viren oder Bakterien bekämpfen. Hier werden zahlreiche unterschiedliche Immunglobuline differenziert, teilweise nach ihrer Funktion, teilweise nach dem Ort ihrer Tätigkeit. Denn es gibt auch Immunglobuline (IgA), die vor allem an den inneren Oberflächen des Körpers, den Schleimhäuten, ihren Dienst tun und "Wanderer zwischen den Welten", also Immunglobuline, die aus dem Blut bei Bedarf an die Schleimhäute beordert werden.
Das zelluläre Immunsystem umfasst Abwehrzellen (so genannte T-Zellen), die primär die Aufgabe haben, Krankheitserreger unmittelbar auszuschalten (vulgo: zu fressen) und solche, die das "immunologische Gedächtnis" bilden und damit die Grundlage einer anhaltenden Immunität nach Krankheit oder Impfung darstellen.
Beide Arten des Immunsystems arbeiten Hand in Hand, so gibt es z.B. von B-Zellen gebildete Antikörper, die es T-Zellen erleichten, Krankheitserreger zu finden und zu fressen und T-Zellen, deren primäre Aufgabe es ist, B-Zellen bei der Antikörper-Bildung zu helfen.
Grundsätzlich werden bei Auseinandersetzungen mit Krankheitserregern oder Impfstoffen immer beide Immunsysteme aktiviert, dies allerdings in sehr unterschiedlichem Maße und mit sehr unterschiedlicher Bedeutung - so gibt es Krankheiten/Impfungen wie die (gegen) Tuberkulose, bei denen der humorale Teil der Abwehr praktisch keine Rolle spielt und es gab Impfungen wie die HiB-Impfung der ersten Generation (nicht mehr in Verwendung!), die im Gegenzug fast ausschließlich über das humorale Abwehrsystem wirkte (Plotkin 2001).
Stellt sich jetzt aus welchen Gründen auch immer die Frage nach dem Vorhandensein einer Immunität nach durchgemachter Erkrankung oder verabreichter Impfung, ist in der Routinediagnostik nur der humorale Anteil der Abwehr (Immunglobuline/Antikörper) unseren Untersuchungen zugänglich - die Diagnostik der zellulären Immunität ist sehr komplex und aufwändig und spielt nur in Einzelfällen und bei sehr besonderen Fragestellungen eine Rolle. Wir erfassen - und dies ist für die weiteren Überlegungen von großer Bedeutung - also mit der Bestimmung von Antikörpern immer nur einen mehr oder weniger kleinen oder großen Teil der Immunsituation des Körpers bezüglich einer bestimmten Erkrankung/Impfung - ein wesentlicher Teil der Immunität bleibt hier immer unberücksichtigt.
Bei der Beurteilung der Immunität nach bzw. der Effektivität von Impfungen wird diese entscheidende Einschränkung jedoch wiederum dadurch relativiert, dass (fast) alle aktuellen Impfungen ihre Wirksamkeit primär über die Bildung von Antikörpern entfalten: "Although mucosal and cellular immune responses are clearly important to protection by some vaccines, most vaccines licensed today depend for their efficacy on serum antibodies." (Plotkin 2010 und 2001).
Dies ist nicht zuletzt auch für die Entwicklung und Zulassung von Impfstoffen von Bedeutung, da diese in diesem Zusammenhang ja ihre Wirksamkeit nachweisen müssen - was ausnahmslos (und in vielen Fällen ausschließlich!) über die Bestimmung der provozierten Antikörper erfolgt. Auch langjährigen STIKO-Mitgliedern scheint dieser Zusammenhang nicht immer präsent, wenn sie die Sinnhaftigkeit von Titerbestimmungen nach Impfungen grundsätzlich in Frage stellen - beruht doch der Wirksamkeitsnachweis der jeweiligen Impfungen eben auf dem Nachweis genau dieser Antikörper-Titer. "Für keine der allgemein empfohlenen sogenannten Basisimpfungen ist routinemäßig eine Kontrolle des Impferfolges vorgesehen oder gar ratsam". (Heininger 2017) bzw. die pauschale Behauptung bezüglich der Masernimpfung, "dass ein positives Laborergebnis keinen Schutz attestiert" (Heininger 2016) - wäre letzteres so, hätte der Impfung im Rahmen der Zulassung auch keine Wirksamkeit attestiert werden können... .
Von entscheidender Bedeutung bei dieser Diskussion sind die folgenden Punkte:
-
dass wir erstens nicht bei jeder Impfung die Frage der Immunität über eine Antikörperbestimmung sicher klären können (s.u.),
-
dass zweitens die Antikörper, die wir in Routineuntersuchungen bestimmen, nicht automatisch diejenigen, sind, die den Schutz bewirken (und damit das Korrelat der Immunität darstellen), sondern manchmal nur diejenigen, die darauf hinweisen, dass außer den gemessenen, für die Immunität nicht entscheidenden, mit Sicherheit auch nicht gemessene, schützende Antikörper entstanden sind (die gemessenen sind dann ein so genannter Surrogat-Parameter der Immunität). Dieser komplizierte Umstand beruht zum einen darauf, dass im Rahmen der Immunantwort eben zahlreiche verschiedene Antikörper mit verschiedenen Funktionen entstehen und zum anderen die Bestimmung der eigentlich entscheidenden Antikörper bei einigen Impfungen für die Routinediagnostik zu aufwändig wäre.
-
Darüber hinaus ist drittens jede Immunität immer nur eine statistische Aussage und damit relativ - ob sie im Einzelfall schützt oder nicht hängt auch von vielen Titer-unabhängigen Faktoren ab: so können Risikofaktoren (wie z.B. Mangelernährung, Rauchen, ...) die eigentlich als schützend gemessene Immunität schwächen oder eine außergewöhnlich große Menge an Krankheitserregern das Immunsystem trotz eigentlich vorhandener Immunität überwältigen und damit dennoch zu einem Krankheitsausbruch führen. "Thus protection is a statistical concept. When we say that a particular titer of antibodies is protective, we mean under the usual circumstances of exposure, with an average challenge dose and in the absence of negative host factors." (Plotkin 2001).
-
Viertens ist in diesem Zusammenhang auch die Frage entscheidend, der Schutz gegen was genau denn gemeint ist. So schützen bei HiB und Masern sehr viel geringere Antikörperspiegel davor, selber zu erkranken (Schutz vor Erkrankung), als es braucht, um auch eine Übertragung an andere zu verhindern (Schutz vor Infektion).
Hier eine Übersicht über einige der in den ersten Lebensjahren von der STIKO empfohlenen Impfungen unter diesem Blickwinkel:
Diphtherie und Tetanus
-
Die entscheidende Bedeutung, die antitoxische Antikörper für die Immunität beider Erkrankungen haben, wird schon dadurch deutlich, dass sowohl bei Diphtherie, als auch bei Tetanus eine passive Impfung existiert, die akut Erkrankte/Gefährdete sofort durch übertragene Antikörper einen (gewissen) Schutz vermittelt. Darüber hinaus gibt es bei Tetanus und Diphtherie einen Nestschutz für Neugeborene von Müttern mit ausreichend hohen Antikörper-Spiegeln.
-
Der Impfschutz durch diese beiden antitoxischen Impfstoffe ist mit hoher Zuverlässigkeit durch eine Antikörpermessung bestimmbar: liegt der Titer zwischen 0,01 und 0,1 IU/ml ist ein Schutz vorhanden, bei Werten über 0,1 IU/ml kann von zuverlässigen Schutz, über 1,0 IU/ml von einem langjährigen Schutz ausgegangen werden (diese Werte gelten bei den hier üblichen, standardisierten Messverfahren mit dem so genannten ELISA-Verfahren) (Borrow/WHO 2007).
-
Dennoch sind in der wissenschaftlichen Weltliteratur einige wenige Fälle beschrieben, bei denen Tetanus (Borrow/WHO 2007) oder Diphtherie (Ipsen 1946) auch bei höheren Antikörper-Spiegeln auftraten - dies ist unter Umständen erklärbar über eine fehlende Diffusion dieser Antikörper an den Ort des Eindringens und der Vermehrung der Erreger (Plotkin 2001).
HiB
-
Bei der Immunität gegen HiB sind Bedeutung und notwendige Titerhöhen schützender so genannter PRP-Antikörper zwar hervorragend untersucht (in großen Studien in Finnland im Rahmen der Einführung der flächendeckenden Impfung (Kayhty 1983)), sie spielen in der Praxis aber keine relevante Rolle, da europäische Impfempfehlungen die HiB-Impfung ohnehin nur bis zum fünften Geburtstag empfehlen, sich die Frage nach eventuellen Auffrischimpfungen also in der Regel nicht stellt.
-
Bei der HiB-Impfung - einer der wenigen Impfungen, die eine Herdenimmunität vermittelt (s. hier) - muss bei der Diskussion der Antikörperspiegel differenziert werden, gegen was genau der Schutz denn bestehen soll: reichen Titer von 0,15 µg/ml PRP-Antikörper zum Schutz vor der Erkrankung aus, bedarf es zur Verminderung der Besiedlung des Nasenrachenraums (und damit der Verhinderung der Erreger-Weitergabe an andere) Titern von mehr als 5 µg/ml (Plotkin 2010, Fernandez 2000).
Pertussis
-
Die "moderne", so genannte azelluläre Keuchhustenimpfung enthält im Gegensatz zum Vorgängermodell keine ganzen Bakterien mehr, sondern nur eine kleine Anzahl definierter Bakterienbestandteile ("Antigene"), die das Immunsystem zur Bildung im Idealfall schützender Antikörper anregen sollen.
-
Diese Antikörper lassen sich differenziert bestimmen, sind aber schon in ihrer einzelnen Bedeutung für den tatsächlichen Schutz, geschweige denn in der dafür notwendigen Höhe hochkontrovers umstritten (Plotkin 2001), so dass Heininger hier zuzustimmen ist, wenn er behauptet "Eine Titerbestimmung ist generell unsinnig, da es für Pertussis keinen Labortest gibt, der eine Korrelation mit Schutz darstellen würde." (Heininger 2017); oder - etwas wissenschaftlicher formuliert: "no unequivocal immunological correlates of protection against pertussis have been identified." (Edwards 2018)
Masern
-
Die Bedeutung der Antikörper im Blut für die Masernimmunität lässt sich schon aus der Effektivität der passiven Impfung (Übertragung fertiger Antikörper an Gefährdete) und am nachweisbaren Nestschutz bei Neugeborenen Masern-immuner Mütter ablesen.
-
Die Effektivität des Schutzes korreliert mit den im Neutralisationstest gemessenen Antikörper-Titern: Werte über 120 vermitteln Schutz vor der Erkrankung, Werte unter 50 keinen Schutz (Strebel 2018, Chen 1990, Orenstein 1987, Albrecht 1981). Die diesen international akzeptierten Werten letztendlich zu Grunde liegenden Untersuchungen von Chen aus dem Jahr 1990 sind jedoch aus verschiedenen Gründen aus heutiger Sicht nicht uneingeschränkt belastbar: sie beruhen nur auf einer sehr überschaubaren Zahl an Untersuchten, verwendeten im Vergleich zu heute eine eingeschränktere Falldefinition von Masern und die verwendete Untersuchungsmethode ist nur unter Vorbehalt auf heutige Laborverfahren übertragbar (Bolotin 2019, Plotkin 2019).
-
Um den Schutz vor der Infektion (Besiedlung und damit Gefahr der Weitergabe an andere) zu vermitteln, bedarf es deutlich höherer Titer von ≥ 1000 mIU/ml (Plotkin 2010).
-
Untersuchungen bei Kindern im Titerbereich zwischen 40 und 125 mIU/ml zeigten die Bedeutung auch der zellulären Immunität bei Masern: waren diese Titer noch reine Leihtiter vom Nestschutz der Masern-immunen Mutter, erkrankten diese Kinder; stammten diese Titer jedoch von einer (nicht optimal wirksamen) Impfung, war von Schutz auszugehen, was nur dadurch erklärbar ist, dass die Impfung zusätzlich zum Antikörperspiegel auch noch eine zelluläre Immunantwort hervorrief, die den Kindern mit einem reinen Leihtiter fehlt (Plotkin 2001, Samb 1995).
Mumps
-
Bei der Entwicklung der Mumps-Impfung erwies sich die Situation als hochkompliziert, zeigte sich doch, dass, obwohl mehrere der verwendeten Stämme gute Titer an neutralisierenden Antikörpern hervorriefen, ein Virus-Stamm eine deutlich geringere klinische Wirksamkeit aufwies (und die ist bei der Mumps-Impfung ohnehin schlecht...). Dieser Stamm zeigte deutlich niedrigere Titer an nicht-neutralisierenden Antikörpern im ELISA, die aber für die eigentliche Schutzwirkung im Gegensatz zu den neutralisierenden Antikörpern als für den Schutz weniger relevant angesehen werden (Plotkin 2001).
-
"The presence of neutralizing antibody is linked to protection; however, numerous attempts to define a level of antibody that correlates with protection have failed." (Rubin 2018).
-
Ebenfalls auffallend ist, dass die Übertragung fertiger Mumps-Antikörper (passive Impfung) einen so unzuverlässigen Schutz vermittelt, dass entsprechende Präparate gar nicht erst zugelassen wurden (Rubin 2018) - auch dies spricht für die zentrale Bedeutung anderer als bloßer Antikörper-vermittelter Mechanismen für die Mumpsimmunität: "no certain serologic correlate of protection is accepted" (Plotkin 2010).
-
Auch die Rolle des zellulären Immunsystems ist bei Mumps unklar: "T-cell responses to mumps vaccine have been demonstrated, but their protective effect is unknown" (Plotkin 2010).
-
Eine Bestimmung der Mumps-Antikörper-Titer bei Geimpften mit dem Ziel, die Frage nach einem Impfschutz zu klären, ist also nicht sinnvoll.
-
Sinnvoll kann aber sein, bei Ungeimpften AK-Titer zu bestimmen, um zu klären, ob es der Impfung überhaupt bedarf - finden sich bei Ungeimpften Antikörper, können diese ja nur von einer (unbemerkt) durchlebten Infektion stammen und es wäre Immunität anzunehmen; eine Impfung wäre dann unnötig.
Röteln
-
Bei der Entwicklung der Röteln-Lebendimpfstoffe zeigte sich, dass die Tatsache, dass überhaupt Antikörper auf einen Impfstoff gebildet werden, noch kein Garant für einen Schutz ist: einige der Impf-Virus-Kandidaten erzeugten zwar im Labor messbare (so genannte Haemaglutinin-)Antikörper, diese korrelieren jedoch nicht mit einer relevanten Immunität, die nur durch so genannte neutralisierende Antikörper vermittelt wird, wie sie durch die Röteln-Erkrankung und durch die jetzt üblichen Impfvirusstämme (RA 27/3) provoziert werden.
-
Da die Messung dieser neutralisierenden Antikörper (dem eigentlichen Korrelat der Immunität) routinemäßig nicht verfügbar ist, hat man Titerhöhen anderer, leichter messbarer Antikörper definiert, die dann (als Surrogat der Immunität) Schutz anzeigen sollen. Werden hier (im so genannten RIA- oder ELISA-Test) Werte über 10 IU/ml gemessen, wird von Schutz ausgegangen (Reef 2018, Plotkin 2010, Matter 1997).
-
Es sind jedoch sowohl eine nachgewiesene Immunität bei deutlich niedrigeren, als auch Erkrankungen trotz deutlich höherer Titer dokumentiert - darunter auch Infektionen Ungeborener bei eigentlich als ausreichend angesehen hohen Antikörper-Titern der Mutter (Reef 2018, Banerjee 2005).
Varizella-Zoster-Virus/Windpocken
-
Auch bei Windpocken beweist die Effektivität einer verfügbaren Passivimpfung und ein Nestschutz die Bedeutung der humoralen Antikörper, das Auftreten von Rückfällen in Form von Gürtelrose bei Nachlassen der zellulären Immunität (z.B. in höherem Alter) weist aber ebenso deutlich auf die Rolle des zellulären Immunsystems für die Gesamtimmunität hin.
-
Als Maß für diese Immunität hat sich die Bestimmung der so genannte FAMA-Antikörper bewährt: bei Titern > 1/64 ist von einem Schutz vor der Erkrankung auszugehen (Plotkin 2001).
-
In der Routineuntersuchung wird in der Regel der ELISA-Test verwendet - hier gewähren Werte oberhalt von 5 IU/ml zuverlässige Immunität (Gershon 2018).
Hepatitis B
-
das Thema der Antikörper-Spiegel bei der Hepatitis B-Impfung ist komplex genug für einen eigenen Artikel...
Poliomyelitis/Kinderlähmung
-
Sowohl bei der Schluckimpfung (OPV), als auch bei der heute in Deutschland ausschließlich verwendeten gespritzten Impfung (IPV) entstehen schützende und messbare Antikörperspiegel im Blut; Titer im Neutralisationstest von ≥ 1/8 werden als zuverlässig schützend angesehen (Plotkin 2010).
-
Dachte man früher, nur OPV allein bilde darüber hinaus noch eine lokale Immunität der Darmschleimhaut aus, weiß man mittlerweile, dass auch nach der IPV die Vermehrung der Polioviren im Nasenrachenraum (also an der Schleimhaut des Verdauungstraktes) vermindert wird - die Stärke dieses Effektes hängt unmittelbar von der Höhe der im Blut gemessenen Antikörperspiegel ab, was nahelegt, dass hier Antikörper aus dem Blut an die Schleimhautoberfläche diffundieren (Plotkin 2010 und 2001).
Pneumokokken
-
Die große Zahl (≥ 90) verschiedener Serotypen innerhalb der Pneumokokkenfamilie (die ja auch die Wirksamkeit der Impfung massiv kompromittiert...) ist auch ein Teil des Problems bei der Antikörper-Bestimmung.
-
Denn auuch hier gilt: die mit dem ELISA-Verfahren gemessenen Antikörper sind nicht das Korrelat der Immunität (sie schützen also nicht selber), sondern nur das Surrogat für das Vorhandensein der eigentlich wirksamen, so genannten opsonophagozytären AK (diese wirken, indem sie die Vernichtung der Bakterien durch die T-Zellen fördern).
-
Das Verhältnis zwischen den ELISA-AK und den opsophagozytären AK ist aber offenbar sehr stark vom jeweiligen Serotyp abhängig (Lee 2003) ... darüber hinaus finden Studien aus Afrika andere Grenzwerte als solche in Europa (Saaka 2008).
-
"Thus, the protective concentration appears to vary, depending on the population, the serotype, and the clinical end point." (Plotkin 2010)
-
Damit kommt der Bestimmung dieser AK in der Praxis eine sehr geringe Bedeutung zu.
Meningokokken
-
Das Problem der Diskrepanz zwischen dem im ELISA gemessenen AK (Surrogat der Immunität) und den eigentlich wirksamen, bakteriziden AK (Korrelat der Immunität) teilen die Meningokokken mit den Pneumokokken.
-
Bei letzteren, die in der Praxis meist nicht gemessen werden, gewährt ein Titer ≥ 1/8 Schutz (Borrow 2005) - dies entspricht zumindest bei Erwachsenen wohl einem ELISA-AK-Titer von ≥ 2µg/ml (Plotkin 2010, Maslanka 1998, Peltola 1977).
- Eine praktische Bedeutung kommt der AK-Bestimmung der Meningokokken in der Regel nicht zu.
FSME
-
"The case for tick-borne encephalitis [FSME] seems reasonably clear: antibodies are protective, and a level of 125 ELISA units is considered sufficient." (Plotkin 2010, Kreil 1997) -
-
Auch hier ist die Titerbestimmung einige Jahre nach der Grundimmunisierung also eine sichere Alternative zur in Deutschland (im Vergleich zu anderen Ländern wie z.B. der Schweiz) sehr häufig empfohlenen Auffrischimpfung.
Es zeigt sich, dass die Frage nach der Sinnhaftigkeit von Titerbestimmungen nach(/vor) Schutzimpfungen wieder einmal etwas komplexer ist, als es sich dogmatische Impfologen oder hardcore-Impfgegner wünschen würden...
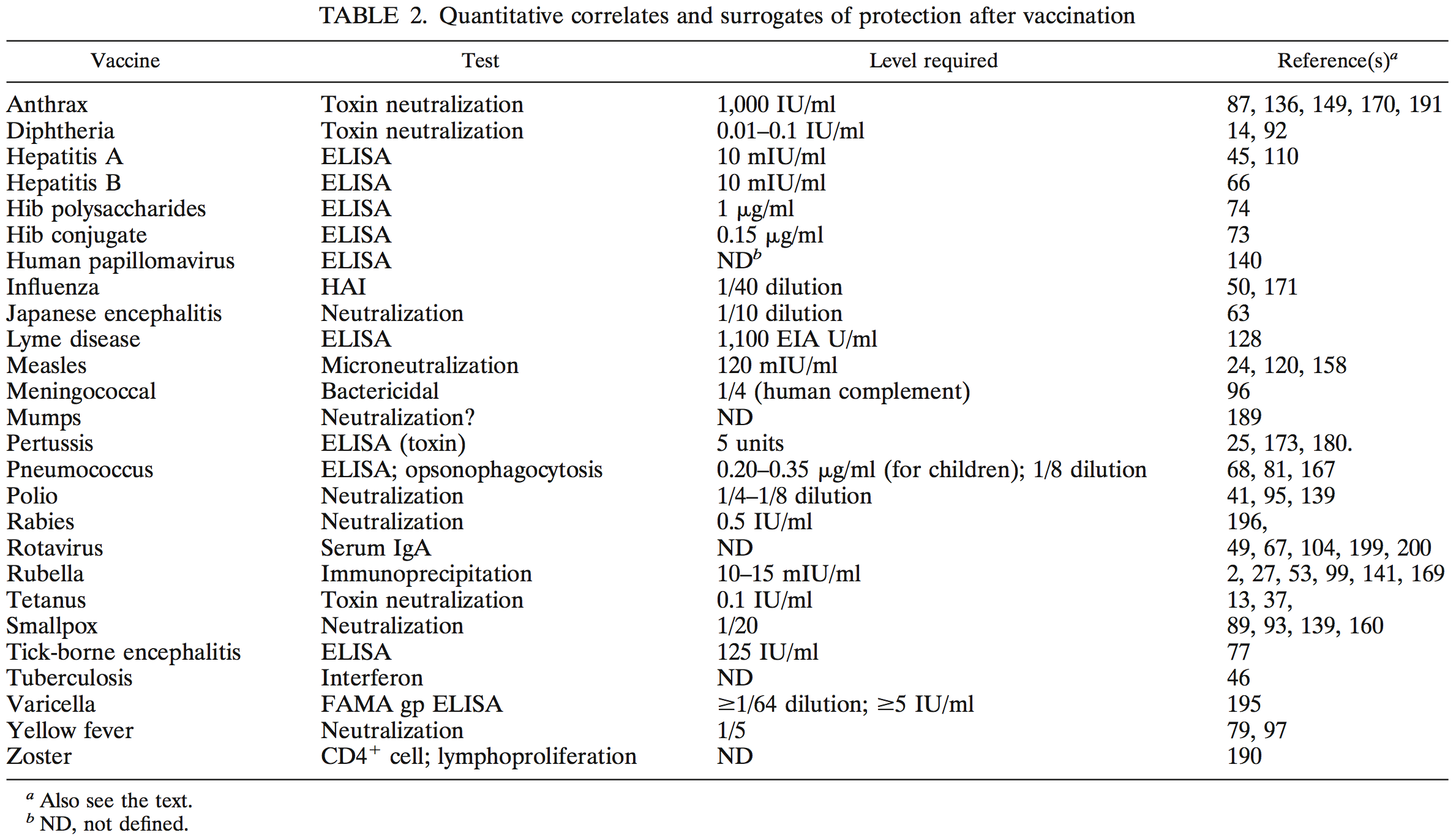
Eine tabellarische Übersicht über Untersuchungsverfahren und entsprechende Grenzwerte (nicht über die Sinnhaftigkeit der Untersuchung!) findet sich bei Plotkin 2010 (die Referenzzahlen beziehen sich auf das Literaturverzeichnis dieser Publikation).
Literatur
Albrecht P. 1981. Int J Infect Dis 1997;1:172– 8
Banerji A. 2005. Canadian Medical Association Journal. 172(13):1678–79
Bolotin S. 2019. The Journal of Infectious Diseases. DOI: 10.1093/infdis/jiz380
Borrow R. 2006. Vaccine 23:2222–2227
Borrow R. WHO, Department of Immunization V and B. 2007. Immunological basis for immunization: Module 3 : Tetanus (update 2006). Geneva: World Health Organization
Chen RT. 1990. J Infect Dis 1990;162:1036 – 42
Edwards KM. 2018. Pertussis Vaccines. Plotkin SA. 2018. Plotkin’s Vaccines. Philadelphia: Elsevier. 7th ed.
Fernandez J. 2000. J. Infect. Dis. 182:1553–1556
Gershon AA. 2018. Varicella Vaccines. Plotkin SA. 2018. Plotkin’s Vaccines. Philadelphia: Elsevier. 7th ed.
Heininger U. 2016. Kinder- und Jugendarzt. 47(4):227
Heininger U. 2017. Ars medici. 2017(4):172-75
Ipsen J.1946. J Immunol. 54:325-347
Kayhty H. 1983. J Infect Dis. 147:1100
Kreil TR. 1997. Clin. Exp. Immunol. 110:358–361
Lee LH 2003. Vaccine 21: 2190–2196
Maslanka SE. 1998. Infect. Immun. 66:2453–2459
Matter L. 1997. J Infect Dis. 1997;175:749-55
Orenstein WA. 1987. J Infect Dis 1987;155:146 –9
Peltola H. 1977. N. Engl. J. Med. 297:686–691
Plotkin SA. 2019. The Journal of Infectious Diseases. DOI: 10.1093/infdis/jiz381
Plotkin SA. 2010. Clinical and Vaccine Immunology. July 2010, p. 1055–1065
Plotkin SA. 2001. The Pediatric Infectious Disease Journal. 20(1):63–75
Reef SE. 2018. Rubella Vaccines. Plotkin SA. 2018. Plotkin’s Vaccines. Philadelphia: Elsevier. 7th ed.
Rubin SA. 2018. Mumps Vaccines. Plotkin SA. 2018. Plotkin’s Vaccines. Philadelphia: Elsevier. 7th ed.
Saaka M. 2008. Vaccine 26: 3719–3726
Samb B. 1995. Pediatr Infect Dis J 1995;14: 203–9
Strebel PM. 2018. Measles Vaccines. Plotkin SA. 2018. Plotkin’s Vaccines. Philadelphia: Elsevier. 7th ed.