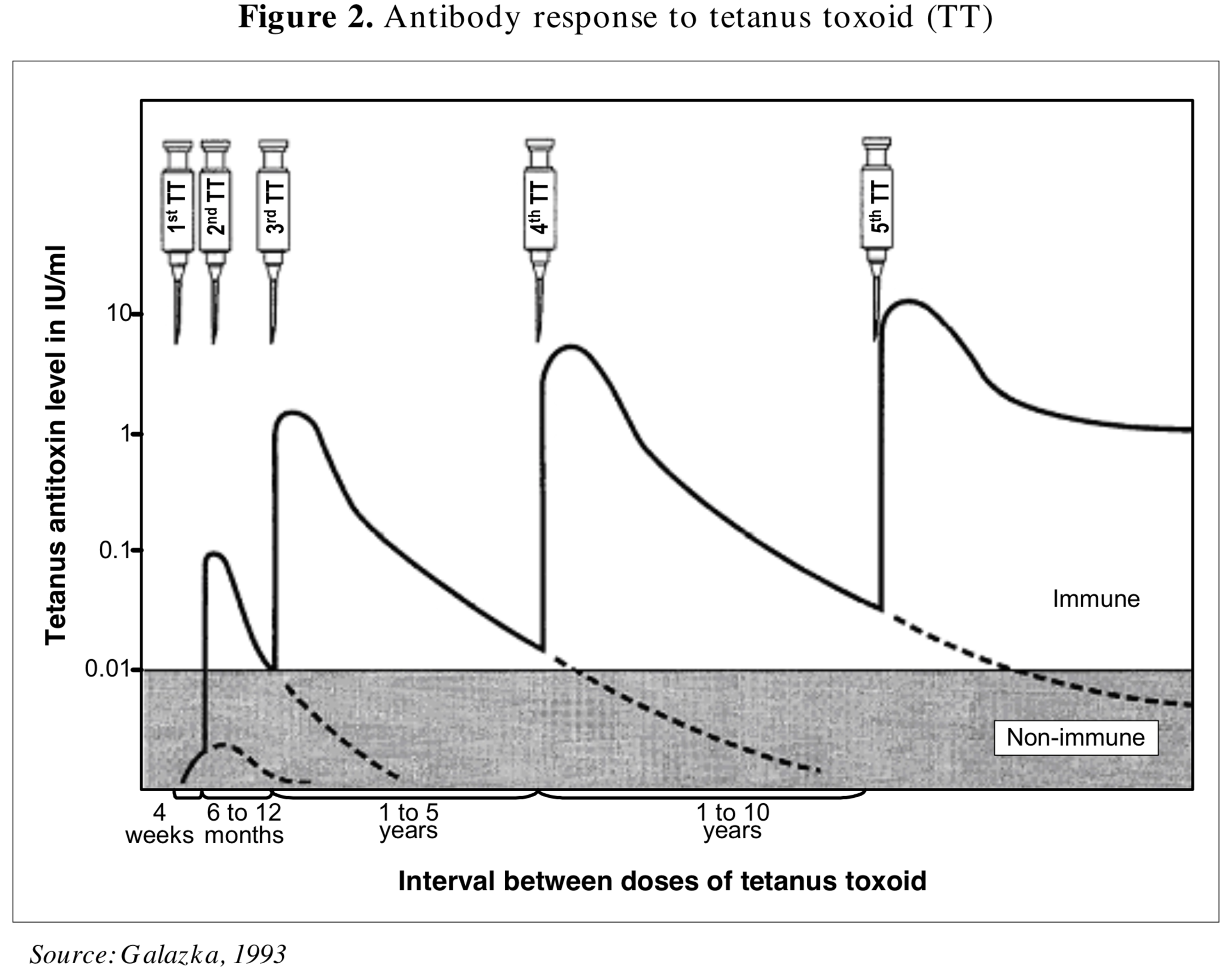
- Aktive Immunisierung: 2 Impfdosen im Abstand von 4 - 8 Wochen, Auffrischung nach ca. 1 Jahr - so genanntes 2+1-Schema.
-
Über die Notwendigkeit weiterer Auffrischungen im Kindes- geschweige denn Erwachsenenalter existieren weder gesicherte Daten, noch ein internationaler Konsens:
-
die STIKO empfiehlt lebenslange Auffrischungen alle 5 - 10 Jahre, was bei einer durchschnittlichen Lebenserwartung von etwa 80 Jahren durchaus 15 bis 20 Impfdosen ergeben kann (davon 6 allein im Kindesalter).
-
die WHO sieht eine lebenslange Immunität nach insgesamt 6 (WHO 2012), Großbritannien und Irland schon nach 5 (ECDC 2016) Tetanusimpfungen bis einschließlich des frühen Erwachsenenalter als gegeben an und empfehlen daher keine routinemäßigen Auffrischungen bei Älteren mehr.
-
Die Empfehlung einer routinemäßigen Auffrischung der Tetanusimpfung "alle 10 Jahre" (wie von der STIKO formuliert) führt die WHO auf Erfahrungen mit dem völlig anders zubereiteten nicht-adsorbierten Vorgänger-Impfstoff zurück, die auf den modernen Impfstoff nicht übertragbar seien (Borrow 2007).
-
Eine amerikanische Studie errechnet die Halbwertszeit der Antikörperspiegel (also die Zeitspanne, nach der sich die Höhe der Antikörperspiegel jeweils halbiert) von Tetanus mit 14, die für Diphtherie-Antikörper mit 27 Jahren und geht von einer mittleren Schutzdauer für 95% der Geimpften bei Tetanus mehr als 50 Jahre, bei Diphtherie für mehr als 30 Jahre nach der jeweils letzten Impfung aus (Hammarlund 2016). Die Autoren schlagen - in Übereinstimmung mit den WHO-Empfehlungen - nach abgeschlossener Grundimmunisierung im Kindesalter eine Auffrischimpfung mit Td-Impfstoff im Alter von etwa 30 und eine weitere im Alter von etwa 60 Jahren vor.
-
Eine niederländische Studie errechnet aus einer sechsmaligen Impfung, von denen die letzte Gabe schon im achten Lebensjahr stattfindet, einen Schutz bis zum Alter von 90 Jahren (de Melker 1999).
-
Das aktuelle Positionspapier der WHO empfiehlt eine Grundimmunisierung mit drei Dosen im Säuglingsalter, eine Gabe im zweiten Lebensjahr, und jeweils eine weitere im Kleinkindes- und Jugendlichen-Alter. Diese Strategie "will induce immunity that lasts through much of adulthood, thus protecting women through their childbearing years" (WHO 2017), führt in anderen Publikationen jedoch eine Grundimmunisierung mit nur drei Dosen innerhalb der ersten beiden Lebensjahre auf (Galazka 1993, entnommen bei Borrow 2007)
-
Die WHO resümiert: "There is not enough evidence to compare the antibody levels for the duration of protection with specific tetanus vaccination schedules." (WHO 2017)
-
Im Verletzungsfalle bei Ungeimpften Passivimpfung (Übertragung fertiger Antikörper, Schutzdauer ca. 6 Wochen)
-
Niederländische Autoren kritisieren in einer Untersuchung die immensen Kosten, die durch die routinemäßige Passivimpfung nicht ausreichend Geschützter im Verletzungsfall entstehen: angesichts des ohnehin relativ geringen Risikos der Tetanusinfektion (s. Wundstarrkrampf - Die Erkrankung) und der geringen Sterblichkeit bei Patienten unter 50 Jahren müssten nach diesen Berechnungen 500.000 Ungeimpfte im Verletzungsfall passiv immunisiert werden, um rechnerisch einen einzigen Fall von Wundstarrkrampf zu verhindern. Die entstehenden Kosten von ca. € 100.000.000 pro verhindertem Todesfall sind in einem Gesundheitssystem mit begrenzten Ressourcen unverhältnismäßig hoch. Die Autoren empfehlen eine Passivimpfung nur bei Frauen über 55 Jahren bzw. Männern über 70 Jahren bei jeweils unklarem Impfstatus (de Melker 2004).
-
-
Ein Wirksamkeitsnachweis im Sinne moderner Arzneimittel oder Impfstoffe fehlt.
-
Nutzenbelege werden abgeleitet aus den Beobachtungen an Soldaten im Zweiten Weltkrieg, als geimpfte Soldaten signifikant seltener an Wundstarrkrampf erkrankten als noch im Ersten Weltkrieg (Long 1947, Boyd 1946)
-
In einer randomisierten Studie aus den sechziger Jahren senkt die zweimalige Impfung von Frauen im gebärfähigen Alter das Wundstarrkrampfrisiko ihrer neugeborenen Kinder signifikant (Newell 1966)
-
-
"In welchem Ausmaß die aktive Immunisierung gegen Tetanus zu dem in Industrieländern bereits ab Beginn des 20. Jahrhunderts beobachteten deutlichen Rückgang der Tetanusinzidenz und -mortalität beigetragen hat, ist schwer abschätzbar." (a-t 2016)
-
"In der Bundesrepublik ging die Tetanusinzidenz von 0,2/100.000 im Jahr 1962 auf 0,02/ 100.000 1990 zurück. Ein Einfluss der 1974 von der Ständigen Impfkommission (STIKO) ausgesprochenen Empfehlung der Tetanusimpfung für Kinder ist nicht erkennbar, wie auch die 1961 in der DDR eingeführte Pflichtimpfung von Kindern und Jugendlichen keinen sichtbaren Effekt auf die Fallzahlen hatte." (at 2016)
-
Allerdings gibt es in der Literatur Einzelfallberichte von Tetanuserkrankungen (teilweise mit tödlichem Ausgang) bei Patienten mit eigentlich als schützend angesehenen Antikörpertitern im Blut (Abrahamian 2000, Pryor 1997) - bei großen Toxinmengen können niedrige Antitoxin-Spiegel offenbar nicht ausreichend sein.
-
Gesamthäufigkeit 3 - 13% (White 1983)
-
Meist lokale Schwellung und Abszessbildung (Church 1985), aber auch schwere allergische und anaphylaktische Reaktionen. Erstere treten vor allem auf, wenn im Verletzungsfall bei noch hohem Antikörperspiegel die Impfung aufgefrischt wird (CDC 2015). Um diese Nebenwirkungen zu reduzieren fordern Fachleute, vor den routinemäßigen Auffrischimpfungen den Antikörpertiter im Serum und damit die Notwendigkeit der Impfung zu bestimmen (Relyveld 1998).
-
Arthritis (13 Fälle innerhalb 15 Jahren in Deutschland, Korger 1986)
Abrahamian FM. J Emerg Med. 2000 Feb;18(2):189-93.
a-t. arznei-telegramm. 2016; 47: 17-20
Bolukbasi O. Eur Neurol 1999;41(4):231-2
Borrow R. 2007. Immunological basis for immunization: Molule 3 : Tetanus (update 2006). Geneva: World Health Organization
Boyd J. Lancet 1946; 1: 113-9
Cisse FA. Med Sante Trop. 2012 Jan-Mar;22(1):103-5.
Church JA. Pediatrcs 1985; 75:899-900
ECDC. Vaccine Schedules. (Abruf 20.02.2016)
Hammarlund E. Clin Infect Dis. 2016 May 1;62(9):1111-8. doi: 10.1093/cid/ciw066. Abruf 26.02.2017
Korger G. Klin Wochenschrift 1986; 64:767-775
Long A. Bull. U.S. Army Med. Dep. 1947; 7: 371-85
De Melker HE. Ned Tijdschr Geneeskd 2004b, 148(9): 429-33
De Melker HE. 1999. Vaccine.18(1–2):100–108.
Newell K. Bull. World Health Organ. 1966; 35: 863-71
Pryor T. J Fam Pract. 1997 Mar;44(3):299-303.
Relyveld EH. Vaccine 1998 May-Jun;16(9-10):1016-23
Whit WG. J of Hygiene 1983; 61:283-297
WHO. 2017. WER 92:53-76.
WHO. Fact sheet Tetanus. Stand 2012(Abruf 20.02.2016)