Im Februar 2007 wurde die HPV-Impfung in einem beispiellosen Hau-Ruck-Verfahren von der STIKO in den Kanon der öffentlich empfohlenen Impfungen aufgenommen - Auch in anderen Ländern wie den USA ist das procedere der Zulassung und Art und Umfang der Impfpromotion Gegenstand intensiver medizinethischer Untersuchungen - auch dies ein in der Impfgeschichte einmaliger Vorgang (Tomljenovic 2012).
-
Kein im Jahr 2023 auf dem Markt befindlicher HPV-Impfstoff enthält sämtliche 13 von der WHO als sicher oder wahrscheinlich krebserregend angesehenen HPV-Typen, geschweige denn die 25, die die IARC als gesichert/wahrscheinlich/möglicherweise krebserregend ansieht.
-
Bei der Herstellung aller Impfstoffe kommt rekombinante DNA zum Einsatz, das Wirkprinzip sind dann so genannte virus-ähnliche Partikel ("virus-like particles"/VLP), die nicht vermehrungsfähig/infektiös sind und verschiedene Wirkverstärker/Adjuvantien.
- Der bivalente Impfstoff Cervarix® enthält die HPV-Typen 16 und 18. Er enthält darüber hinaus einen neuartigen Wirkverstärker (AS04 - Aluminiumhydroxyphophat-Sulfat/AAHS). Speziell dieses Adjuvans gab Anlass zu scharfer Kritik an der EMA-Zulassung, da es offensichtlich keine Studien zur Sicherheit dieser neuartigen Aluminiumverbindung vor der Zulassung gab: "The EMA reports that AAHS was introduced without any prelicensure safety evaluation. The adjuvant is described by the company to be both physically and functionally distinct from all other previously used aluminium adjuvants." (Petersen 2021). (Eine der zahllosen Unregelmäßigkeiten in der Zulassung der HPV-Impfstoffe....)
-
Der Impfstoff Gardasil® (in D nicht mehr verwendet) enthält Kapseleiweißbestandteile der HPV-Typen 6, 11, 16 und 18.
- Der Impfstoff Gardasil 9® enthält die HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52 und 58 (und ebenfalls AAHS) und deckt damit - laut RKI (RKI FAQ 2022) (nur) "etwa 90% aller Hochrisiko-HPV-Infektionen" ab.
-
Die für die Zulassung wesentlichen Studien sind bis heute nicht vollständig veröffentlicht, sie liegen lediglich in Form einer Zusammenfassung vor. Damit entzieht sich die wissenschaftliche Grundlage der Impfung einer herstellerunabhängigen Überprüfung. Eine Übersichtsarbeit aus dem Jahr 2013 nennt Studiendesign und Dateninterpretation der Zulassungsstudien zu Gardasil "largely inadequat" (Tomljenovic 2013). Zahlreiche Analysen der Zulassungsstudien fanden und finden massive Unregelmäßigkeiten und äußern den Verdacht systematischer Datenmanipulationen und -unterschlagungen (s. z.B. hier, hier, hier).
-
Grundsätzlich lösen die HPV-Impfstoffe - zum einen wohl durch die intramuskuläre Verabreichung, zum anderen auch durch die enthaltenen Wirkverstärker - eine stärkere serologische Immunantwort (Antikörperbildung) aus als eine natürliche Infektion.
-
Nachdem - auch bedingt durch die lange Latenz zwischen Infektion und der dadurch sehr seltenen ausgelösten Entstehung eines Gebärmutterhalskrebses - jahrzehntelang nur so genannte "Surrogatparameter" als Wirknachweis angeführt wurden (Antikörperbildung, Verringerung von Genitalwarzen, Verringerung von Dysplasien/CINs) gibt es jetzt erste Studien, die auch in europäischen Ländern eine tatsächliche Verringerung von Zervixkarzinom-Fällen zeigen.
-
Die bislang methodisch stärkste Untersuchung, eine landesweite schwedische Studie auf der Grundlage verschiedener Impfregister zeigte bei einer Studiendauer von über 10 Jahren eine relative Risikoverringerung ("Impf-Effektivität") von 88%, wenn die Impfung vor dem 18. Lebensjahr und von 53%, wenn die Impfung zwischen dem 18. und 31. Lebensjahr durchgeführt wurde (Lei 2020)
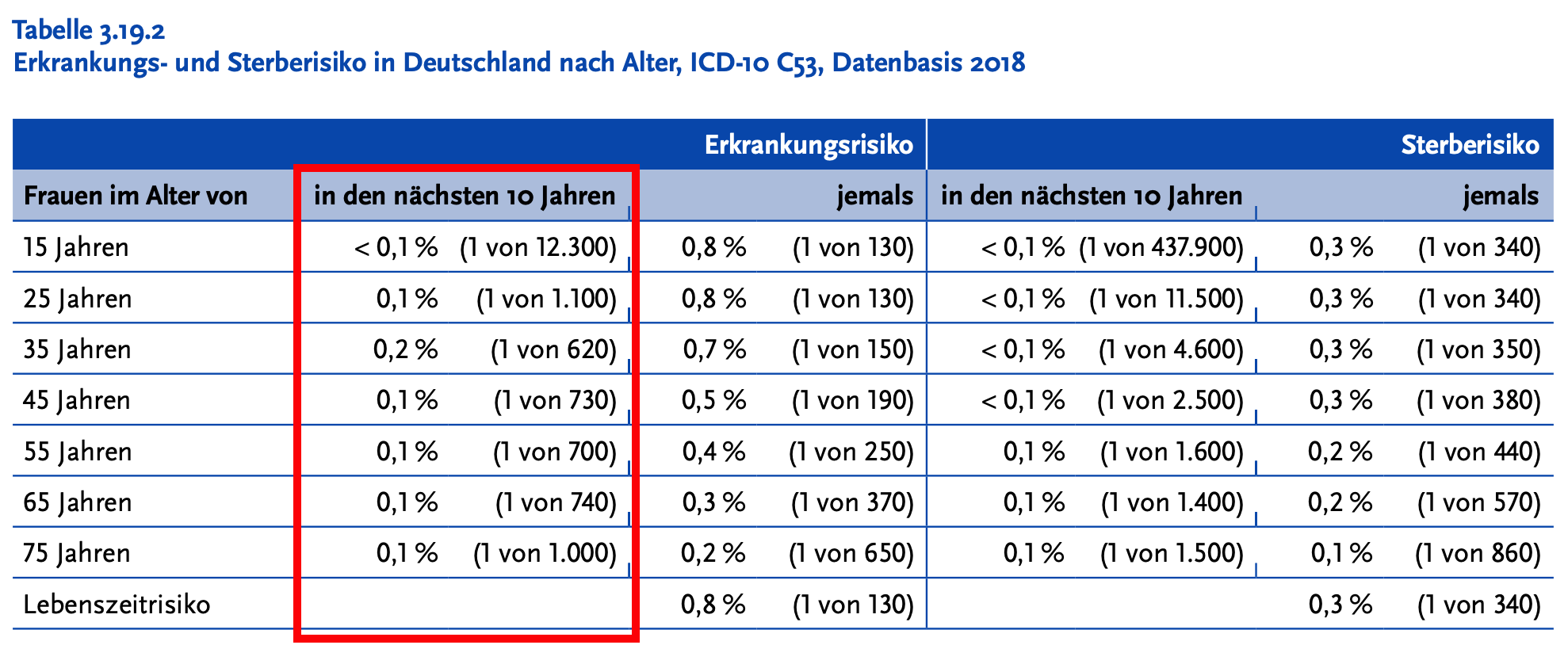
- Bei einer Erkrankung mit einem so geringen absoluten Erkrankungsrisiko - gerade für die Haupt-Zielgruppe der Impfung: junge Mädchen und junge Frauen - ist es von entscheidender Bedeutung, sich wieder einmal den Unterschied zwischen einer relativen Risikoreduktion (das ist die "Impfstoff-Effektivität", hier z.B. 88%) und der absoluten Risikoreduktion vor Augen zu führen (für détails hierzu siehe hier): das absolute Risiko, innerhalb der nächsten 10 Jahre an einem Gebärmutterhalskrebs zu erkranken gibt das RKI wie folgt an - es beträgt für die Hauptzielgruppe der 15-jährigen Frauen 1/12.300 oder 0,008% (bzw. dezimal ausgedrückt 0,00008)
-
- Um die wirkliche Bedeutung der "Impfstoff-Effektivität von 88%" der HPV-Impfung auch für Nicht-Statistiker greifbar zu machen, sei es erlaubt, diese beiden Zahlen in einer sehr groben Annäherung zusammenzubringen (dies ist keine streng wissenschaftliche Berechnung sondern dient nur dazu, eine Größenordnung vorstellbar zu machen!):
- Die RRR (hier 88% bzw. 0,88) berechnet sich nach 1 minus relatives Risiko (RR); in diesem Fall also:
1 - RR = 0,88;
damit beträgt das RR 0,12
-
- Das RR ist aber per definitionem das Verhältnis des absoluten Risikos (AR) der Geimpften zum AR der Ungeimpften:
RR = ARgeimpft/ARungeimpft
0,12 = ARgeimpft/0,00008
damit beträgt das ARgeimpft etwa 0,00001
und die Verringerung des absoluten Risikos zu erkranken (ARR) etwa 0,00007 oder 0,007%
-
-
Die HPV-Impfung verringert das Risiko 15-jähriger Mädchen, innerhalb von 10 Jahren an einem Zervixkarzinom zu erkranken um 0,007% (genauer: Prozentpunkte) - das klingt schon wesentlich weniger eindrucksvoll als eine "Impfstoff-Effektivität von 88%", ist aber immer noch wenig anschaulich.
-
Aus der ARR kann man jedoch die Anzahl der Mädchen errechnen, die geimpft werden müssten, um innerhalb von 10 Jahren einen Fall eines Zervixkarzinoms zu verhindern (number needed to vaccinate/NNV) - sie berechnet sich als 1/ARR, also
-
NNV = 1/0,00007 ≈ 14.000
-
-
Wenn die HPV-Impfung also - wie derzeit allgemein empfohlen - vor dem ersten Sexualkontakt/bis zum 15. Geburtstag erfolgt, müssten um in den folgenden 10 Jahren einen Fall von Gebärmutterhalskrebs zu verhindern etwa 14.000 Mädchen geimpft werden.
-
Analog kann man die NNV für junge Frauen zwischen 20 und 30 abschätzen (! nicht: berechnen) - legt man hier das AR zugrunde, das das RKI für 25-Jährige angibt (1/1100) und die Impfstoff-Effektivität (RRR) aus der schwedischen Studie für die Altersgruppe zwischen 18 und 30 (53%) ergibt sich folgende Annäherung:
-
RR= ARgeimpft/0,0009 = 0,47
ARgeimpft = 0,0004
ARR = 0,0005 = 0,05%
und damit eine NNV von etwa 2100
-
-
Um mit einer HPV-Impfung im zweiten Lebensjahrzehnt in den folgenden 10 Jahren einen Fall von Zervixkarzinom zu verhindern, müssten also in einer groben Annäherung etwa 2000 Frauen geimpft werden.
-
-
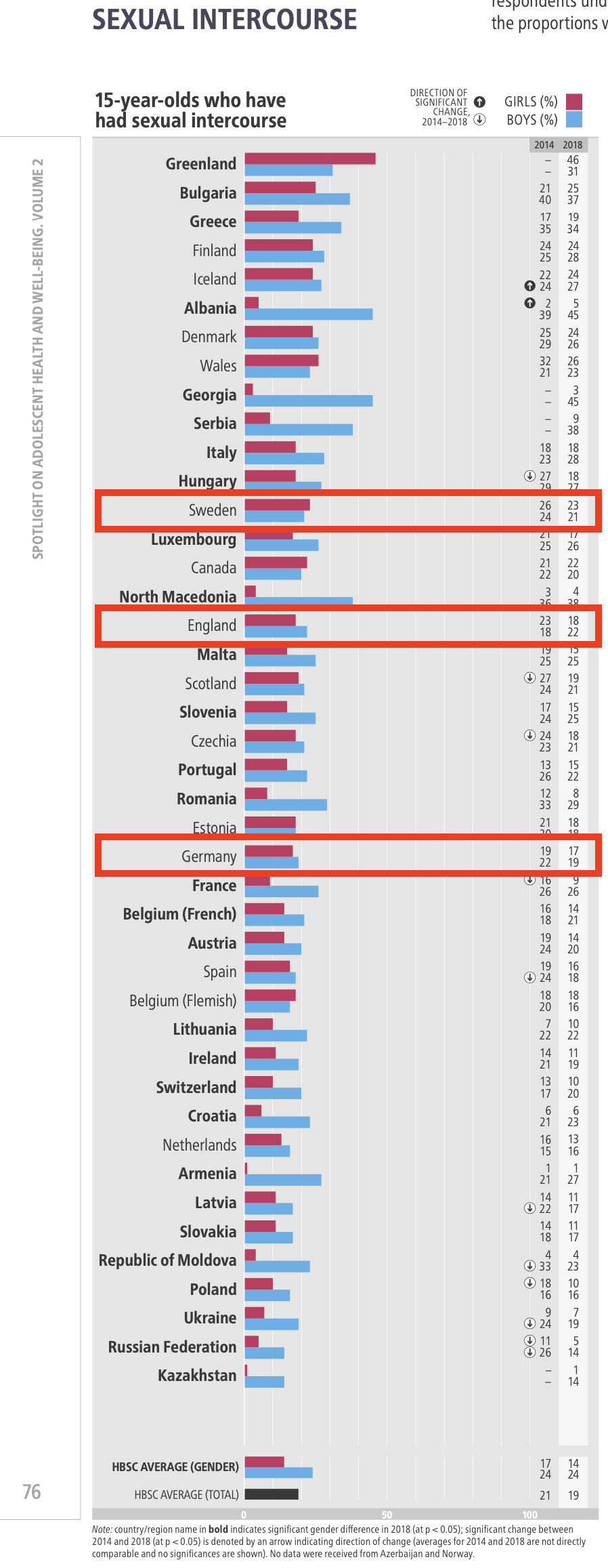
Eine ebenfalls registerbasierte Studie aus Großbritannien differenzierte stärker nach dem Alter bei der Impfung und fand eine Impfstoff-Effektivität von 87% nur bei der Impfung im Alter von 12 oder 13 Jahren. Eine HPV-Impfung im Alter von 14 bis 16 Jahren wurde mit einer VE von 62%, im Alter von 16 bis 18 Jahren nur mehr mit 34% angegeben (Falcaro 2021).
- Dies ist insofern eine interessante Differenzierung, als nicht davon ausgegangen werden muss, dass mit 14 - 16 Jahren schon die Mehrzahl der britischen Jugendlichen sexuell aktiv wäre: der Anteil der Jugendlichen, die im Alter von 15 Jahren bereits Sexualität erlebt haben, ist sowohl in Schweden, als auch in Großbritannien als den beiden Ländern, aus denen diese Studien stammen (und auch in D...) unter 25% (WHO 2020):
- Das deutsche Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen IQWiG - ein Hort evidenzbasierter Medizin - hilft bei der Einordnung: es bringt den Wert der Impfung im Verhältnis zu dem der in Deutschland flächendeckend verfügbaren Früherkennungsuntersuchung prägnant auf den Punkt (IQWiG 2021 - ein insgesamt lesenswerter Artikel zur Krebsfrüherkennung bei Gebärmutterhalskrebs):
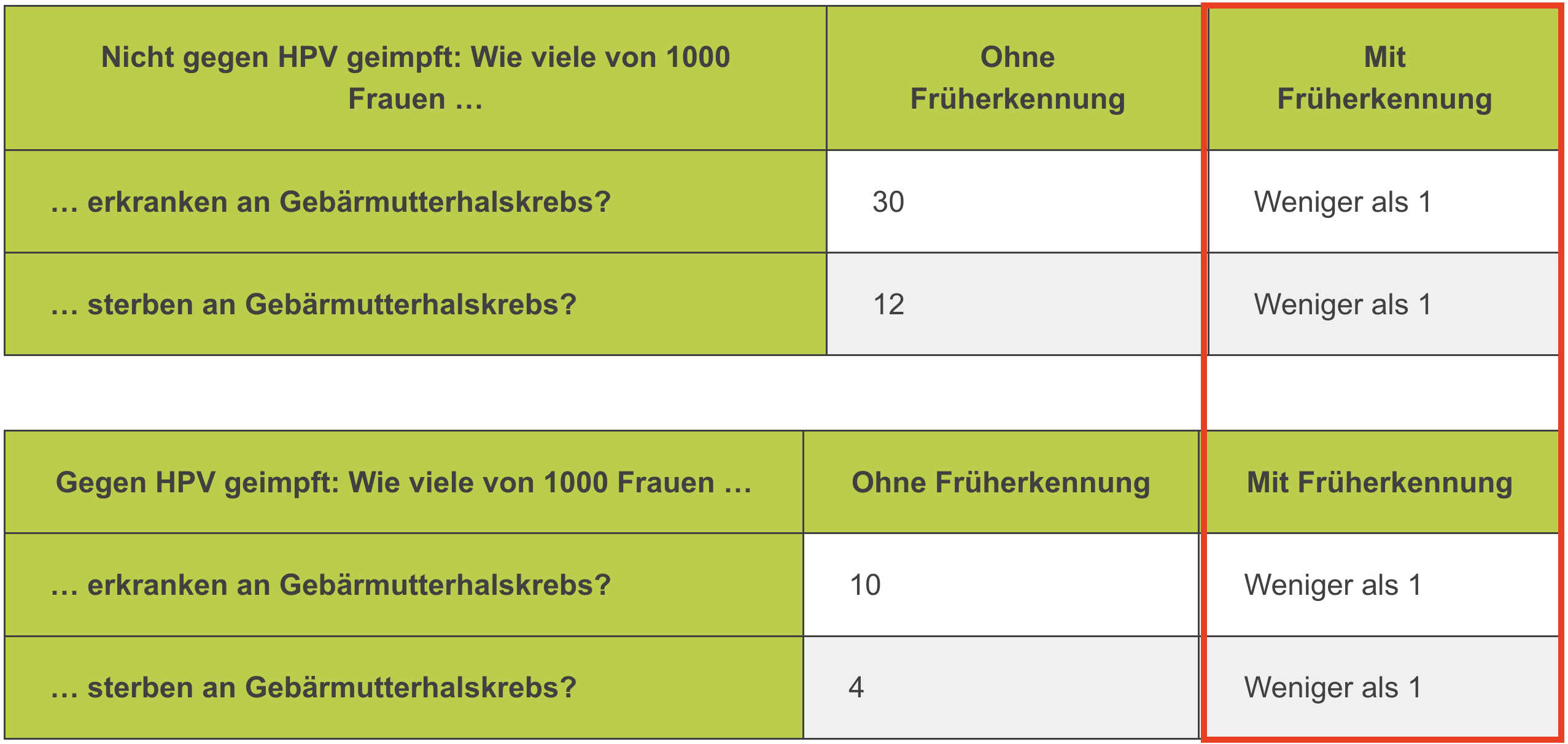
- Diese Graphik zeigt sehr deutlich, dass das Risiko, an Gebärmutterhalskrebs zu erkranken und zu sterben, das primär zwischen HPV-geimpften und -ungeimpften Frauen deutlich unterschiedlich ist, durch die regelmäßige Früherkennung für beide Gruppen (!) auf ein sehr, sehr niedriges Niveau reduziert wird.
Daten aus Deutschland
-
Eine mittelgroße Studie (N= 1226) mit jungen Frauen zwischen 20 und 25 Jahren aus D (Loenenbach 2023) ergab beruhigende und enttäuschende Daten zu Infektionshäufigkeit mit und Impfstoff-Effektivität gegen HPV:
-
Beruhigend, weil die Prävalenz der im HPV-Impfstoff enthaltenen Serotypen bei jungen Frauen in D auch ohne Impfung niedrig ist: selbst bei den Hochrisiko-HPV-Typen 16/18 lag die Prävalenz bei maximal 7% und dies in einem Alter, in dem die Mehrzahl der Studienteilnehmerinnen bereits sexuellen Kontakt gehabt haben dürften.
-
Enttäuschend, weil diese Prävalenz durch die Impfung zwar tendentiell verringert wird, die Vertrauensbereiche der jeweiligen Häufigkeiten sich aber überlappen, was die wissenschaftliche Belastbarkeit dieses Umstandes kompromittiert.
-
-
Enttäuschend auch, weil die sich hieraus ergebende Impfstoff-Effektivität gegen eine Infektion mit den Hochrisiko-HPV-Typen 16/18 mit 46,4% (und absurd großem Vertrauensbereich von 4,2 - 70,1) spürbar unter 50% liegt - der allgemeinen Marke für eine relevante klinische Wirksamkeit von Impfstoffen.
-
Wie aus diesen Daten eine Bestätigung der STIKO-Impfempfehlung abgeleitet werden kann, die erstens junge Mädchen weit vor Beginn der sexuellen Aktivität erfasst und zweitens unverändert (und wissenschaftlich überholt) an mehreren Impfdosen festhält, bleibt ein Geheimnis der Autoren...
-
Außer mit dem Gebärmutterhalskrebs werden HPV auch mit einigen anderen Krebsarten in Zusammenhang gebracht, u.a. Karzinome des Mund- und Rachenraumes. Hier konnte eine - allerdings durch massive Interessenkonflikte der Autoren belastete - Studie eine Verringerung der HPV 16/18-Infektionen im Mund/Rachen-Raum nach der Impfung nachweisen (Herrero 2013).
-
Anfang 2012 erschien eine Studie, die den Einfluss der tetravalenten HPV-Impfung auf Genitalwarzen, Penis- und Analkarzinome bei jungen Männern (16 - 23 Jahre alt) untersucht (Giuliano 2011). Für die harmlosen Genitalwarzen lässt sich in dieser Untersuchung eine signifikante Schutzwirkung durch die Impfung nachweisen, keiner jedoch auf Zellveränderungen im Penis-, Damm- oder Analbereich, die mögliche Vorstufen von bösartigen Veränderungen darstellen könnten. In der Untersuchung einer Teilgruppe der oben genannte Studie ließ sich zwar ein Schutzeffekt vor niedrig- und höhergradigen Zellveränderungen im Analbereich nachweisen, erstere sind jedoch in ihrer Bedeutung als Krebsvorstufen (ganz analog zu den Zellveränderungen bei Frauen am Gebärmutterhals) hochumstritten und der Schutz vor letzteren lässt sich nur nachweisen, wenn man die Untersuchung auf die im Impfstoff enthaltenen HPV-Typen als Auslöser begrenzt - eine Reduzierung der Dysplasien insgesamt lässt sich nicht nachweisen (at 2011).
-
Eine US-amerikanische Studie von 2022 kann nachweisen, dass die Häufigkeit von Analkarzinomen nach Einführung der HPV-Impfung nur bei den Bevölkerungsgruppen zurückging, die grundsätzlich Zielgruppe der Impfstrategie waren - in anderen Bevölkerungsgruppen nahm die Häufigkeit weiter zu; naturgemäß ist diese Form der Studie methodisch wenig belastbar... (Berenson 2022)
-
Das RKI (RKI FAQ 2022) räumt ein, dass "zum jetzigen Zeitpunkt noch keine bzw. kaum Effekte auf das Auftreten dieser Tumore" nachgewiesen seien und führt das auf die im Vergleich zum Gebärmutterhalskrebs noch längere Zeitdauer zwischen Ansteckung und Krebsentstehung zurück. Die zitierte Studie von Berenson (s.o.) behauptet aber für das Analkarzinom ausdrücklich das genaue Gegenteil ("Adequate time has passed for HPV vaccinations to have affected SCCA incidence because anal neoplasia develops and progresses to become a malignant neoplasm faster than other HPV-related cancers." Berenson 2022) und "begründet" daher die schon wenige Jahre nach der US-amerikanischen HPV-Impfempfehlung zu beobachtende Reduktion der Analkarzinome in der Impf-Zielgruppe mit der Impf-Wirkung...
-
Es gibt Hinweise, dass nach Einführung der HPV-Impfung HPV-Infektionen auch bei Ungeimpften zurückgehen - dies spräche für einen Herdeneffekt, für den allgemein eine Impfquote von mindestens 50% angenommen wird (Rosenblum 2021, Tabrizi 2014)
-
Mittlerweile weisen Studien auf einen Fremdschutz durch die HPV-Impfung zumindest für den Endpunkt Genitalwarzen hin: in Ländern, in denen nur Mädchen und Frauen gegen HPV geimpft wurden, nahm die Häufigkeit der Genitalwarzen auch bei (den nicht geimpften) heterosexuellen Männern ab (Herweijer 2018, Bollerup 2016, Ali 2013).
-
Eine Metaanalyse der WHO aus dem Jahr 2019 findet jedoch auch vier bis acht Jahre nach Einführung der Mädchen/Frauen-Impfung keinen signifikanten Rückgang der HPV-Infektionen bei Jungen und Männern (Drolet 2019): "Non-significant decreases in prevalence of HPV 16 and 18 (RR 0·35, 95% CI 0·09–1·40) and HPV 31, 33, and 45 (RR 0·31, 95% CI 0·06–1·58) were observed among boys aged 16–19 years in the first 4 years of girls-only vaccination. The decreases were very similar after 5–8 years of HPV vaccination in the study by Chow and colleagues. No significant changes were observed among men aged 20–24 years."
-
Auch die oben zitierte schwedische Studie von Lei zum Zervixkarzinom weist darauf hin, dass sie trotz einer Impfquote von über 50% und gezielter Analyse der Daten zu dieser Frage keinen Hinweis auf einen Herdeneffekt fand, führt dies allerdings auf die geringe absolute Zahl der Krebserkrankungen und die zu kurze Nachbeobachtungszeit zurück.
-
Eine schwedische Studie aus dem Jahr 2023 (Pimenoff 2023) untersuchte finnische Daten zu verschiedenen Szenarien der HPV-Impfung: die Häufigkeit der Infektion mit unterschiedlichen HPV-Typen wurde verglichen zwischen Gemeinden ohne HPV-Impfung, solchen, in den nur junge Frauen und solchen, in denen Frauen und Männer gegen HPV geimpft wurden. Die gute Nachricht war, das besonders in letzteren Gemeinden 4 und 8 Jahre nach Beginn der Impfkampagne einige derjenigen Risiko-HPV-Typen, die in der neun Typen umfassenden Impfung enthalten sind, deutlich zurückgingen, mit einer vor allem in diesem letzten Szenario (Impfung von Frauen und Männern) ausgeprägten Herdenimmunität (also dem Schutz vor Infektion auch Ungeimpfter durch die Immunität der Geimpften). Allerdings zeigte sich, dass ebenfalls in genau diesen Gemeinden das replacement-Phänomen, also der Ersatz der Impfstoff-HPV-Typen gegen andere, ebenfalls potentiell krebserregende HPV-Typen besonders ausgeprägt war. Dieses Problem wurde bei HPV schon lange vermutet und mit dieser Studie differenziert bewiesen. Experten des Deutschen Krebsforschungszentrums zeigen sich überrascht über die Schnelligkeit, mit der dieses replacement nur wenige Jahre nach Impfbeginn nachweisbar ist und halten es für plausibel, dass langfristig die beiden Haupt-Zieltypen der gesamten Impfkampagne, die Hochrisiko-HPV-Typen 16 und 18, durch andere Hochrisikotypen ersetzt werden (DÄ 2023).
-
Die Grundimmunisierung umfasste initial 3 Impfungen, wobei die zweite Impfung 2 Monate nach der ersten und die dritte 6 Monate nach der zweiten Impfung erfolgen soll. Bei der seit Herbst 2014 empfohlenen Impfung ab dem 9. Lebensjahr sind von der STIKO nur 2 Impfungen im Abstand von 6 Monaten vorgesehen. Diese "Einsparung" einer Impfdosis (nur 2 statt 3) ist eines der wesentlichen Werbeargumente für die HPV-Impfung in einem Alter (9 Jahre), in dem in der Regel auch mittelfristig noch kein Infektionsrisiko besteht.
- Spätestens seit 2022 ist klar, dass die Verabreichung nur einer einzigen HPV-Impfdosis für den erreichbaren Schutz völlig ausreicht (Hervorhebung von mir):
"Data from immunogenicity trials, post-hoc analyses of efficacy trials, and post-licensure observational studies among females have demonstrated that a single dose of HPV vaccine is sufficient to elicit an immune response that provides similar protection as a multidose regimen against initial and persistent HPV infection." (WHO 2022).
-
Damit entfällt natürlich jedes Argument, Mädchen - wie von der STIKO auch 2023 unverändert empfohlen - schon Jahre vor Beginn sexueller Aktivität zu impfen...
- Die WHO weist bei den bi- und tetravalenten Impfstoffen auf hohe Antikörper-Spiegel über mindestens 12, bei dem neueren nonavalenten Impfstoff über mindestens 6 Jahren hin (für letzteren liegen noch keine längerfristigen Daten vor) - gleichzeitig aber auch darauf, dass kein sicheres serologisches Korrelat eines Schutzes bekannt ist. Als Beleg wird jedoch ein Papier zitiert, dass die wissenschaftliche Belastbarkeit dieser Annahmen stark relativiert (Hervorhebung von mir):
"Low quality of scientific evidence that HPV vaccine confers long term protection against cervical cancer in immunocompetent females. The need for a booster dose will have to be assessed once more long-term data on efficacy against cervical cancer becomes available." (WHO o.J.).
- Hier liegt ein potentielles Problem der Impfstrategie: wenn es durch die HPV-Impfung zu keinem letztendlich lebenslang erreichbaren Schutz käme (oder dieser durch spätere booster-Dosen erreichbar wäre) könnte uns ein mögliches Verschieben der Infektion und Erkrankung in ein höheres Lebensalter drohen (ähnlich wie bei Mumps oder Masern), in dem die Spontanremissionen von Dysplasien/CINs wesentlich seltener und das Fortschreiten hin zu invasiven Krebserkrankungen häufiger ist. Die Frage also, ob die HPV-Impfung das Zervixkarzinom-Risiko über die gesamte Lebenszeit der Frau reduziert, bleibt derzeit offen.
-
Angesichts der Vielzahl möglicher Serotypen ist früh befürchtet worden, dass es zu einer Verschiebung im HPV-Spektrum bezüglich der Krankheitsentstehung kommt, wie wir es von z. B. HiB oder Pneumokokken bereits kennen („replacement“) (Gerhardus 2009).
-
Erste Hinweise hierfür gab es ebenfalls bereits früh: So finden sich schon jetzt bei HPV-Geimpften Erkrankungen, die durch nicht im Impfstoff enthaltene HPV-Serotypen ausgelöst werden häufiger, als bei Ungeimpften (Sawaya 2007, EMEA 2006) – hier ist eine engmaschige, differenzierte und langfristige Überwachung der HPV-Infektionen unabdingbar, um Phänomene einer bloßen Keimverschiebung wie z. B. bei den Pneumokokken rechtzeitig aufzudecken.
-
In Costa Rica wurde die Einführung des 2-fach-HPV-Impfstoffs Cervarix™ 2004/2005 von einer großen Studie begleitet, die geimpfte Frauen über mittlerweile 11 Jahre gegen eine Kontrollgruppe beobachtete (initial randomisiert gegen eine Kontrollgruppe, die einen Hepatitis A-Impfstoff erhielt, nach Entblindung dann gegen eine ungeimpfte Kontrollgruppe) (Shing 2022).
-
Erfasst wurden hochgradige Zellveränderungen, die als potentielle Vorstufen eines Gebärmutterhalskrebses angesehen werden (CIN 2+ und CIN 3+).
-
Pro 1000 Geimpfte kam es bei den Geimpften im Vergleich zur Kontrollgruppe
-
zu einer Verringerung der Gesamtzahl der CIN 2+-Befunde bei Geimpften um 27
-
zu einer Zunahme der CIN 2+-Befunde durch nicht im Impfstoff enthaltene HPV-Typen bei Geimpften um 9,2 (entspricht diesbezüglich einer Impfstoff-Wirksamkeit von –71.2% (95% Vertrauensbereich, –164.0 to –12.5))
-
zu einer Zunahme der CIN 3+-Befunde durch nicht im Impfstoff enthaltene HPV-Typen bei Geimpften um 8,3 (entspricht diesbezüglich einer Impfstoff-Wirksamkeit von –135.0% (95% Vertrauensbereich, –329.8 to –33.5))
-
-
Auch wenn damit die Gesamtbilanz ("net benefit") der hochgradigen Zellveränderungen zugunsten der Geimpften ausfällt, sehen die Autoren die Gefahr, dass langfristig die Wirksamkeit der Impfung durch diesen offenbar auftretenden Verschiebe-Effekt abgeschwächt wird.
-
Einschränkend ist zu bemerken, dass es sich bei den CIN-Befunden um mögliche Krebsvorstufen, nicht um Krebserkrankungen handelt und dass der untersuchte Impfstoff ein 2-fach-Impfstoff ist, in D mittlerweile aber ein 9-fach-Impfstoff empfohlen wird.
-
Dennoch ist hiermit erstmals methodisch belastbar nachgewiesen, dass es auch bei HPV zu einem klinisch relevanten replacement-Phänomen kommt (wie z.B. bei den Pneumokokken), dessen langfristige Auswirkungen (auch für einen 9-fach-Impfstoff) noch völlig unklar sind).
-
- Eine schwedische Studie aus dem Jahr 2023 (Pimenoff 2023) untersuchte finnische Daten zu verschiedenen Szenarien der HPV-Impfung: die Häufigkeit der Infektion mit unterschiedlichen HPV-Typen wurde verglichen zwischen Gemeinden ohne HPV-Impfung, solchen, in den nur junge Frauen und solchen, in denen Frauen und Männer gegen HPV geimpft wurden. Die gute Nachricht war, das besonders in letzteren Gemeinden 4 und 8 Jahre nach Beginn der Impfkampagne einige derjenigen Risiko-HPV-Typen, die in der neun Typen umfassenden Impfung enthalten sind, deutlich zurückgingen, mit einer vor allem in diesem letzten Szenario (Impfung von Frauen und Männern) ausgeprägten Herdenimmunität (also dem Schutz vor Infektion auch Ungeimpfter durch die Immunität der Geimpften). Allerdings zeigte sich, dass ebenfalls in genau diesen Gemeinden das replacement-Phänomen, also der Ersatz der Impfstoff-HPV-Typen gegen andere, ebenfalls potentiell krebserregende HPV-Typen besonders ausgeprägt war. Dieses Problem wurde bei HPV schon lange vermutet und mit dieser Studie differenziert bewiesen. Experten des Deutschen Krebsforschungszentrums zeigen sich überrascht über die Schnelligkeit, mit der dieses replacement nur wenige Jahre nach Impfbeginn nachweisbar ist und halten es für plausibel, dass langfristig die beiden Haupt-Zieltypen der gesamten Impfkampagne, die Hochrisiko-HPV-Typen 16 und 18, durch andere Hochrisikotypen ersetzt werden (DÄ 2023).
-
Besonders schwer wiegt bei der Beurteilung der Impfstoff-Sicherheit, dass zahlreiche Autoren den HPV-Zulassungsstudien Unregelmäßigkeiten speziell bei Erfassung und Dokumentation von unerwünschten Arzneiwirkungen (UAW) nachweisen und den Verdacht auf systematische Datenmanipulation äußern (s. z.B. hier, hier, hier; auch Mühlhauser 2018).
-
Auch im Jahr 2020 kommt eine systematische Übersichtsarbeit über Nutzen und mögliche Risiken der HPV-Impfstoffe aus der Feder dreier erfahrener Cochrane-Experten zu einem problematischen Urteil: "At 4 years follow-up, the HPV vaccines decreased HPV-related cancer precursors and treatment procedures but increased serious nervous system disorders (exploratory analysis) and general harms. As the included trials were primarily designed to assess benefits and were not adequately designed to assess harms, the extent to which the HPV vaccines’ benefits outweigh their harms is unclear. Limited access to clinical study reports and trial data with case report forms prevented a thorough assessment." [Bei einer Nachbeobachtungszeit von vier Jahren führten die HPV-Impfstoffe zu einer Verringerung der HPV-bedingten Krebsvorstufen und der Behandlungsverfahren, aber zu einer Zunahme schwerer Störungen des Nervensystems (explorative Analyse) und allgemeiner Schäden. Da die eingeschlossenen Studien in erster Linie auf die Bewertung des Nutzens ausgelegt waren und nicht hinreichend auf die Bewertung der Schäden, ist nicht klar, inwieweit der Nutzen der HPV-Impfstoffe die Schäden überwiegt. Der begrenzte Zugang zu klinischen Studienberichten und Studiendaten mit Fallberichtsformularen verhinderte eine gründliche Bewertung.] (Jørgensen 2020)
-
Die WHO weist auf die Zulassungsstudien und große, bevölkerungsweite Studie hin, die die Sicherheit der HPV-Impfstoffe belegt und keine Anhaltspunkte für das vermehrte Auftreten von Auto-Immunerkrankungen, Multipler Sklerose, CRPS (s.u.) etc. gefunden hätten (WHO 2022).
-
Hierzu ist jedoch wichtig zu berücksichtigen, dass gerade die Zulassungsstudien Gegenstand schärfster wissenschafltlicher Kritik sind und hier der Verdacht auf massive Datenmanipulationen besteht.
-
Und nicht erst seit den Covid-Impfstoffen ist bekannt, dass UAW-Risiken in großen, bevölkerungsweiten Studien verschwinden/verschwimmen können, obwohl sie für einzelne kleine Bevölkerungsgruppen ein hochrelevantes und statistisch signifikantes Risiko darstellen - dies galt und gilt z.B. für das Myokarditis-Risiko junger Männer nach mRNA-Impfstoffen und das Thrombose-Risiko junger Frauen nach Virus-Vektor-Impfstoffen. In beiden Fällen zeigte die bevölkerungsweite Betrachtung kein oder kein alarmierendes Signal, obwohl die Subgruppen in hochgradig alarmierendem Umfang betroffen waren. Studien zur Impfstoff-Sicherheit können daher auch "zu groß" im Sinne von zu undifferenziert sein.
-
- Daher kommt der Dokumentation dieser UAW in herstellerunabhängigen Studien wie im Folgenden eine besondere Bedeutung zu:
-
Lokalreaktionen wie Schmerzen, Schwellung, Rötung und Juckreiz sind sehr häufig, sie treten selbst nach Herstellerangaben bei bis zu 84% der Geimpften auf.
-
Ebenfalls häufig sind verschiedenartige Schmerzzustände im Bereich des Bewegungsapparates, die, je nach unterschiedlicher Begleitsymptomatik als so genanntes "Komplexes regionales Schmerzsyndrom" (CRPS) oder sogar als Fibromyalgie (Martinez-Lavin 2014) auftreten. Das gehäufte Auftreten dieses CRPS nach der Impfung führte im Sommer 2013 dazu, dass die HPV-Impfung in Japan nicht mehr empfohlen wurde (Chustecka 2015, Ikeda 2015, Kinoshita 2014, PEI 2013, Richards 2012).
-
Bewusstlosigkeit oder (Fast-)Kollaps (Brinth 2015) (presyncope or syncope) nach der Impfung tritt so häufig auf, dass in einer Studie zu Cervarix schon von einer "gewöhnlichen Reaktion" ("common reaction") gesprochen wird - immerhin 15% der geimpften Mädchen und Frauen kollabierten nach der Impfung (oder zumindest fast) (Naleway 2012). Das Risiko einer tatsächlichen Bewusstlosigkeit nach der Impfung ("Synkope") ist sechsfach erhöht (Klein 2012).
-
Eine mögliche Ursache könnte hier ein so genanntes posturales Tachykardie-Syndrom (POTS - durch Lageänderung bedingte krankhafte Beschleunigung des Herzschlags) nach der Impfung sein: es sind hier mehrere Fälle, teilweise mit Bewusstseinsverlust, beschrieben, deren Beschwerden nach der HPV-Impfung auftraten und auch nach mehreren Jahren nicht vollständig ausheilten. Von den Autoren der entsprechenden Studie wird eine mögliche autoimmunologische Ursache (s.u. - molekulares Mimikry) angenommen (Blitshteyn 2014).
-
Einzelne Studien sehen als mögliche gemeinsame Ursache von CRPS, Fibromyalgie und POTS die möglicherweise durch den HPV-Impfstoff ausgelöste Schädigung von Nervenfasern des vegetativen (sympathischen) Nervensystems, die zu einer vegetativen Dysregulation führt (Martinez-Lavin 2015).
-
Auch neurologische Nebenwirkungen werden beobachtet, so z.B. eine cerebelläre Ataxie, d.h. eine durch einer Kleinhirnentzündung ausgelöste, schwere Gang- und Bewegungsstörung (Yonee 2013). Auch das Auftreten einer Multiplen Sklerose im engen zeitlichen Zusammenhang mit der Impfung wird immer wieder beschrieben (Geier 2016, Sutton 2009), ebenso Entzündungen des Sehnerven ("Optikusneuritis"), die ebenfalls als Teil so genannter demyelinisierender Erkrankungen klassifiziert wird (Chang 2016).
- Besonderes Augenmerk ruhte früh vor allem auf den autoimmunologischen Nebenwirkungen des HPV-Impfstoffes (Geier 2016, Anaya 2015, Geier 2015, Geier 2014): außer seinem neuen Wirkverstärkersystem AS04, das hochimmunogen ist und daher für autoimmunologische Phänoneme prädisponiert, sind auch die verwendeten Virus-Antigene hochproblematisch. Vergleicht man die Eiweißstruktur von HPV 16 mit der des Menschen, so sind 82 Hepta- und 2 Oktapeptide (mittelgroße Eiweißmoleküle) identisch - diese spielen eine zentrale Rolle bei zentralen Prozessen im menschlichen Organismus wie Zellteilung, Differenzierung der weißen Blutkörperchen, Spermienbildung, Eiweißsynthese. Eine Arbeit von 2009 zu diesem Thema kommt denn auch zu dem Schluss:
„Die Anzahl und Lokalisation der viralen Übereinstimmungen machen das Auftreten autoimmunologischer Kreuzreaktionen beim Menschen nach der Impfung mit HPV 16-haltigen Impfstoffen fast unvermeidlich.“ (Kanduc 2009). Eine Studie aus dem Jahr 2014, spricht von einer "solid evidence of a causal relationship" zwischen der Impfung und autoimmunologischen UAWs und stellt fest "the risk vs. benefit of vaccination is still to be solved" (Pellegrino 2014).
-
Eine 2024 in Vaccine veröffentlichte retrospektive Kohortenstudie aus Kolumbien (Maldonado 2024) verglich über 10 Jahre das Auftreten einer Reihe autoimmunologischer Erkrankungen in einer Kohorte HPV-geimpfter junger Frauen (n= 55.000) mit einer entsprechenden Kontrollgruppe nicht-HPV-geimpfter junger Frauen (n=370.000).
-
Das Risiko für Autoimmunerkrankungen war in der geimpften Gruppe deutlich erhöht: für Rheumatoide Arthritis um das 4,4-fache, für Juvenile idiopathische Arthritis um das 2,8-, für Idiopathische thrombocytopenische Purpura das 2,5- und für Schilddrüsenüberfunktion um das 2,9-fache
-
Auch wenn die Schlussfolgerung der Autoren "For rheumatoid arthritis, juvenile idiopathic arthritis, idiopathic thrombocytopenic purpura, and thyrotoxicosis; the application of the vaccine had an effect on the development of the disease." die methodisch bedingte Aussagekraft ihrer Arbeit überstrapaziert, wird hier ein alarmierendes Risikosignal veröffentlicht, dem dringend in prospektiven Studien nachgegangen werden muss.
-
Besonders schwer wiegt der Verdacht, dass einzelne Antigenbestandteile des Impfstoffs die Blut-Hirn-Schranke überwinden und im Gehirn eine u.U. tödliche Autoimmunvaskulitis (Gefäßentzündung im zentralen Nervensystem) auslösen könnten - eine Untersuchung aus dem Jahr 2012 hält dies für eine mögliche Ursache einzelner Todesfälle, die bei jungen Frauen im zeitlichen Zusammenhang mit der HPV-Impfung aufgetreten sind (Tomljenovic 2012b).
-
Einzelne Studien finden ein deutlich erhöhtes Risiko für eine der schwersten autoimmunologischen Erkrankungen, den systemischen Lupus erythematodes (Geier 2016, Gatto 2013, Soldevilla 2012). Auch schwere immunologische Augenentzündungen (Uveitis, Papillitis) wurden nach der HPV-Impfung immer wieder beobachtet (Dansingani 2015, Holt 2014).
-
Das frühzeitige Organversagen der weiblichen Eierstöcke bei jungen Frauen in Folge der HPV-Impfung ist mittlerweile ebenfalls vielfach beschrieben und wird als impfassoziierte, durch die enthaltenen Begleitstoffe ausgelöste Autoimmunerkrankung (ASIA für autoimmune syndrome induced by adjuvants) betrachtet (Geier 2016, Gruber 2015, Colafrancesco 2013, Little 2012). Auch das enthaltene Aluminium kommt als Ursache in Frage, hier sind in Tierversuchen entsprechende Veränderungen an den Eierstöcken reproduzierbar gewesen (Gruber 2015).
-
Beschrieben sind nach der Impfung darüber hinaus allergische Reaktionen bis hin zum Asthmaanfall sowie Gelenkentzündungen und immunologische Hautentzündungen (Erythema nodosum) (Longueville 2012).
Ali H. 2013. BMJ 2013; 346 doi: https://doi.org/10.1136/bmj.f2032
Anaya JM. Clin Exp Rheumatol. 2015 Jul-Aug;33(4):545-8. (Abruf 31.03.2016)
arzneitelegramm 2011; Jg. 42: 95-96
Berenson AB. 2022.
Blitshteyn S. Eur J Neurol. 2014;21(1):135-9. doi: 10.1111/ene.12272. Epub 2013 Sep 16.
Bollerup S. 2016. Sex Transm Dis. 2016 Apr;43(4):238-42. doi: 10.1097/OLQ.0000000000000418.
Brinth L. Dan Med J 2015;62(4):A5064. Abruf 01.07.2015
Brotherton, J.M.L. Lancet 2011;377:2085-92
Castellsagué, X. Br. J. Cancer 2011; 105: 28-37
CDC, Pressemitteilung vom 25.10.2011
Chang H. Clin Neurol Neurosurg. 2016 Mar 29;144:126-128. doi: 10.1016/j.clineuro.2016.03.023. (Abruf 07.04.2016)
Chustecka Z. 2015. Abruf 14.07.2015
Colafrancesco S. Am J Reprod Immunol. 2013 Oct;70(4):309-16. doi: 10.1111/aji.12151.
Dansingani KK. Ophthalmic Surg Lasers Imaging Retina. 2015 Oct;46(9):967-70. doi: 10.3928/23258160-20151008-11. Abruf 10.05.2016
Dt. Ärzteblatt. 09.11.2023. https://www.aerzteblatt.de/nachrichten/147204/HPV-Impfung-Erfolgreiche-Herdenimmunitaet-aber-Ausbreitung-anderer-Varianten
Falcaro M. 2021. Lancet. 2021 Dec 4;398(10316):2084-2092.
Garnett JP. J Clin Virol 2000, 19(1-2): 101–111
Gatto M. Clin Rheumatol. 2013 Sep;32(9):1301-7. doi: 10.1007/s10067-013-2266-7.
Geier DA. Clin Rheumatol. 2014; 34:2846. DOI: 10.1007/s10067-014-2846-1. Abruf 01.07.2015
Geier DA. Clin Rheumatol. 2015 Jul;34(7):1225-31. doi: 10.1007/s10067-014-2846-1. Abruf 25.04.2016
Geier DA. Immunol Res. 2016 Jul 13. DOI: 10.1007/s12026-016-8815-9. Abruf 15.07.2016
Gerhardus A. Dtsch Arztebl 2009; 106(8): A-330 / B-284 / C-276
Giuliano, A.R. N. Engl. J. Med. 2011;364:401-11
Gruber N. Curr Opin Obstet Gynecol. 2015 Aug;27(4):265-70. doi: 10.1097/GCO.0000000000000183. Abruf 03.06.2016
Herweijer E. 2018. Vaccine 2018;36:1917-1920.
Herrero R. 2013. PLoS One. 2013 Jul 17;8(7):e68329. doi: 10.1371/journal.pone.0068329.
Holt HD. Curr Drug Saf. 2014 Mar;9(1):65-8.
Ikeda S. Brain Nerve. 2015 Jul;67(7):835-43. doi: 10.11477/mf.1416200222. (Abruf 31.03.2016)
IQWiG. 2021. https://www.gesundheitsinformation.de/gebaermutterhalskrebs-frueherkennung-und-vorsorge.html. Abruf 25.03.2023
Jørgensen L. Syst Rev 9, 43 (2020). https://doi.org/10.1186/s13643-019-0983-y. Abruf 25.03.2023
Kanduc D. Intern J of Med and Med Sciences. Vol. 1(9) pp. 383-387, September, 2009
Kinoshita T. Intern Med 53: 2185-2200, 2014. Abruf 27.06.2015
Klein NP. Arch Pediatr Adolesc Med. 2012 Dec;166(12):1140-8. doi: 10.1001/archpediatrics.2012.1451.
Lei J. 2020. N Engl J Med 2020; 383:1340-1348. DOI: 10.1056/NEJMoa1917338
Little DT. BMJ Case Rep. 2012 Sep 30;2012. pii: bcr2012006879. doi: 10.1136/bcr-2012-006879.
Loenenbach A. 2023. https://doi.org/10.3389/fpubh.2023.1204101
Longueville C. Rev Med Interne. 2012 Mar;33(3):e17-8. Epub 2011 Mar 23.
Maldonado I. 2024. https://www.sciencedirect.com/science/article/abs/pii/S0264410X24002639
Martinez-Lavin M. J Clin Rheumat 2014 Oct; 20(7):392-93
Martinez-Lavin M. Clin Rheumat July 2015;34 (7):1165-69. Abruf 01.07.2015
Miltz A. PLoS One. 2014 Mar 3;9(3):e90348. doi: 10.1371
Mühlhauser I. 2018. https://www.ebm-netzwerk.de/de/medien/pdf/ebm-11_18_kvh-journal_cochrane.pdf. Abruf 25.03.2023
Naleway AL. J Womens Health (Larchmt). 2012 Apr;21(4):425-32. Epub 2012 Jan 9.
Paavonen, J. Lancet 2009; 374: 301-14
PEI. Bulletin zur Arzneimittelsicherheit 3/2013.
Pellegrino P. Autoimmun Rev. 2014 Jul;13(7):736-41. doi: 10.1016/j.autrev.2014.01.054. Epub 2014 Jan 24.
Petersen SB. 2021. BMJ Evid Based Med. 2021 Dec;26(6):285-289. doi: 10.1136/bmjebm-2020-111419.
Pimenoff VN. 2023. https://doi.org/10.1016/j.chom.2023.10.001
RKI FAQ 2022. https://www.rki.de/SharedDocs/FAQ/Impfen/HPV/FAQ-Liste_HPV_Impfen.html. Abruf 29.03.2023
Rosenblum HG. 2021.MMWR Morb Mortal Wkly Rep. 2021 Mar 26;70(12):415-420. doi: 10.15585/mmwr.mm7012a2.
Saraiya, M. Lancet 2011;377:2057-8
Sawaya, G. F. N Engl J Med 2007, 19: 1997-3
Shing JZ. 2022. https://doi.org/10.1016/S1470-2045(22)00291-1
Soldevilla HF. Lupus. 2012 Feb;21(2):158-61.
Sutton, I. Mult Scler 2009, 15(1):116-9
Tabrizi SN. 2014. Lancet Infect Dis . 2014 Oct;14(10):958-66. doi: 10.1016/S1473-3099(14)70841-2
Tomljenovic L. J Law Med Ethics. 2012 Fall;40(3):673-81. doi: 10.1111/j.1748-720X.2012.00698.x.
Tomljenovic L. (2012b) Pharmaceut Reg Affairs 2012, S12:001.
Tomljenovic L. Curr Pharm Des. 2013;19(8):1466-87.
WHO. 2020. Spotlight on adolescent health and well-being. Findings from the 2017/2018 Health Behaviour in School-aged Children (HBSC) survey in Europe and Canada. International report. Volume 2. Key data. Abruf 28.03.2023
WHO. 2022. WER No 50, 2022, 97, 645–672
WHO. o.J. Duration of protection conferred by HPV vaccination in immunocompetent females.
Yonee C. Neuropediatrics. 2013 Oct;44(5):265-7. doi: 10.1055/s-0033-1333873. Epub 2013 Feb 1.