Seit Juli 2006 ist die Impfung gegen Meningokokken C in Deutschland eine für alle Kinder empfohlene Schutzimpfung.
-
Die bis dahin verwendeten so genannten Polysaccharid-Impfstoffe waren im Kleinkindesalter nicht wirksam.
-
Verwendet werden jetzt so genannte Konjugatimpfstoffe gegen Meningokokken der Gruppe C, in denen die Bakterienbestandteile an Diphtherie- oder Tetanustoxoid gebunden sind, wodurch es auch bei Kindern unter 5 Jahren zu einer Antikörperbildung kommt.
- Auch bei später geimpften Kindern kommt es bereits nach einem Jahr zu einer deutlichen Abnahme der Antikörper: statt initial bei 90% ließ sich nach einem Jahr ein als schützend angesehener Titer nur noch bei 60% der Untersuchten nachweisen (at 2006)
-
Einer Übersichtsarbeit aus Großbritannien zu Folge waren dort von den 465 Meningokokken C-Fällen im Zeitraum von 2000 bis 2003 immerhin 53 Kinder geimpft (Auckland 2006).
-
Auch in Deutschland sind mittlerweile MenC-Fälle bei MenC-geimpften Kindern aufgetreten, teilweise mit einem Abstand zur Impfung von nur 10 Monaten und auch ein tödlicher Verlauf wurde bei einem geimpften Kind dokumentiert (RKI 2016).
-
Die Dauer eines eventuellen Impfschutzes ist weitgehend unklar. Bei einer einmaligen Impfung nach dem 1. Geburtstag ist die Wirkdauer der Impfung (gemessen an den nachweisbaren Antikörpern SBA (serum bactericidal antibodies)) wohl nur kurz: eine Studie, die die entsprechenden Antikörper weniger als zwei Jahre nach der Impfung untersuchte, fand nur bei gut einem Drittel der untersuchten Kinder noch als schützend angesehen Antikörperspiegel (Snape 2005). Dieser rasche Abfall zeigte sich auch in einer Arbeit aus dem Jahr 2010, die von der WHO zitiert wird (Borrow 2010)
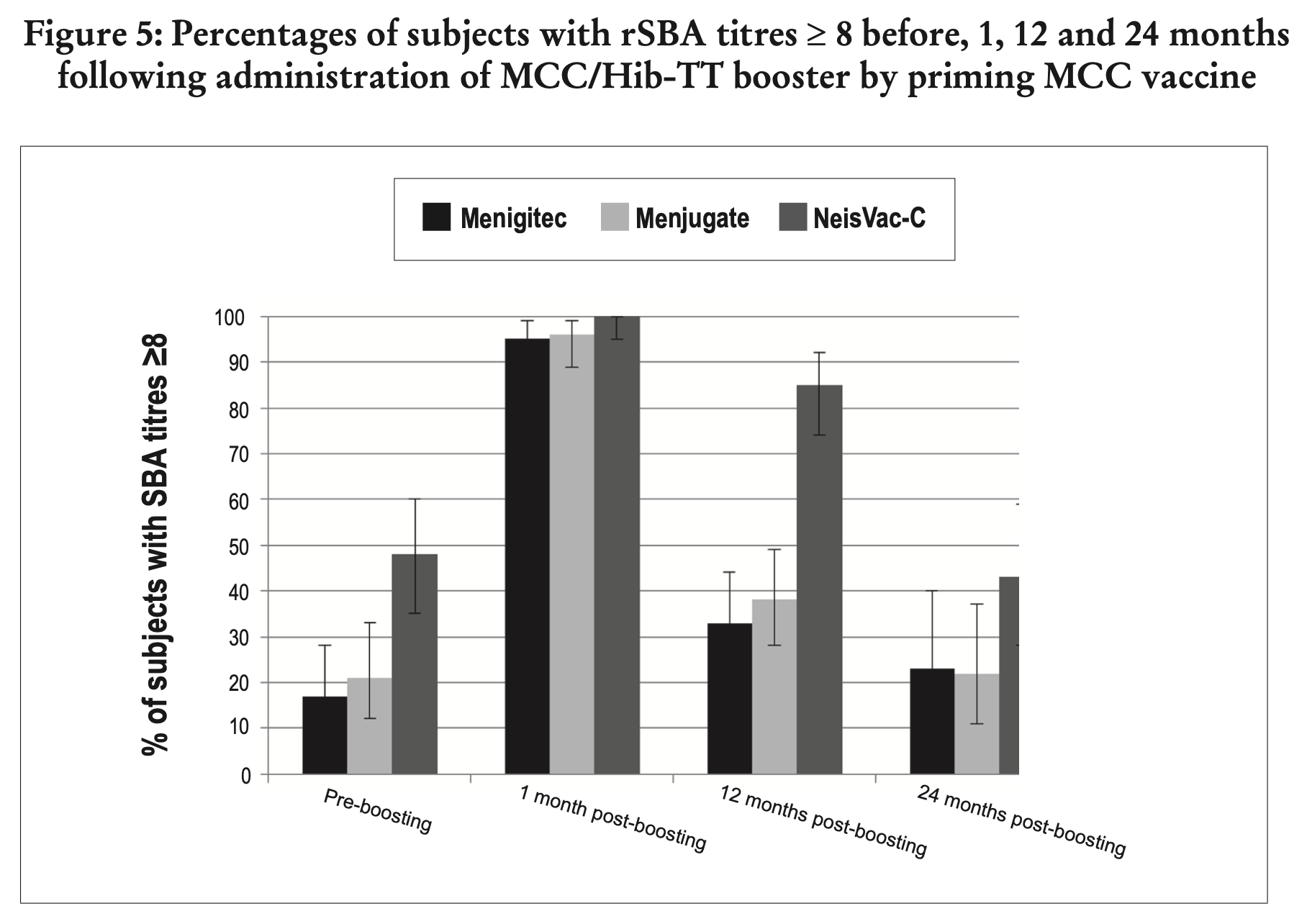
-
Die Hoffnung auf ein Fortdauern der Immunität durch ein immunologisches Gedächtnis erfüllte sich nicht: der Schutz ist - laut WHO - tatsächlich an die Präsenz der SBA gebunden (WHO 2020)
-
Auch Beobachtungsstudien zur klinischen Effektivität der Men C-Impfung - z.B. aus Großbritannien - zeigten nach initial hoher Wirksamkeit ein deutliches Absinken der Effektivität binnen weniger Jahre, so dass selbst die WHO hier einräumt, dass das wahre Ausmaß des Schutzes für Säuglinge und Kleinkinder unklar ist (WHO 2020)
-
Insgesamt scheinen invasive Meningokokkenerkrankungen in Ländern mit schon langjähriger entsprechender Impfempfehlung (wie z.B. Großbritannien) deutlich zurückzugehen (Department of health 2011, Campbell 2010) - dieser Trend (ein Rückgang der Häufigkeit der Meningokokken-Erkrankungen) betrifft allerdings erstens auch Länder, in denen nicht gegen MenC geimpft wird und zweitens wesentlich auch die MenB-Erkrankungen, gegen die bislang nur in sehr wenigen westeuropäischen Ländern geimpft wird (näheres zur Epidemiologie der Erkrankungen s. hier).
-
Die Untersuchung eines brasilianischen Ausbruchs von Meningokokken C-Erkrankungen ergab keinen nennenswerten Schutzeffekt der MenC-Impfung bezüglich des Trägerstatus oder der Übertragung von Meningokokken-Erkrankungen (Sáfadi 2014).
-
Auch bei den Meningokokken sind Befürchtungen geäußert worden, es könne – wie bei HiB oder den Pneumokokken – zu einer Verschiebung im Erregerspektrum („replacement“) kommen (at 2006). Mittlerweile gibt es hier erste, beunruhigende Hinweise:
-
in einer großangelegten Untersuchung in Großbritannien konnte nachgewiesen werden, dass es parallel zur Einführung der Impfung gegen Meningokokken C zu einem deutlichen Rückgang dieses Erregertyps in den untersuchten Rachenabstrichen kam, gleichzeitig kam es zu einer deutlichen Zunahme des Serotyps B, der von der Impfung nicht erfasst wird und z.B. in Deutschland ohnehin die große Mehrzahl der Meningokokkenerkrankungen auslöst (Ibarz-Pavón 2011).
-
In den letzten Jahren und damit zeitlich parallel zur MenC-Impfung nehmen in Großbritannien schwere Men-Erkrankungen durch den früher fast bedeutungslosen Serotyp W zu (Campbell 2016, Ladhani 2015) - auch in Deutschland nehmenErkrankungen durch diesen vor der Men-Impfung raren Serotypen zu (RKI 2016).
- In Afrika, namentlich in Nigeria und anderen Ländern des so genannten "meningitis belt", wurde seit 2013 durch großangelegte Men A-Impfkampagnen die Häufigkeit von Men A-Erkrankungen drastisch reduziert - seit 2015 wütet in Nigeria jetzt "the largest ever global epidemic of serogroup C meningitis" (Nnadi 2017, Sidikou 2016).
-
- "Ein ausgeprägter Herdeneffekt [d.h. der Schutz auch der Ungeimpften durch die gegen Men C Geimpften] wurde bislang nicht beobachtet" (RKI 2016)
- Bisher beschriebene UAWs umfassen neben Lokalreaktionen auch Reizbarkeit, Schlafstörungen bei Kleinkindern, Anaphylaktische Reaktionen, schwere, potentiell lebensbedrohliche Hautreaktionen (Erythema multiforme, Stevens-Johnson-Syndrom), Kleinhirnschädigung (Ataxie; Cutroneo 2014) und Krampfanfälle (at 2006).
- Guillain-Barré-Syndrom (Brigham 2009)
- Neuere Untersuchungen lassen den Verdacht aufkommen, Konjugatimpfstoffe wie die HiB- (und auch die Meningokokken-) Impfung könnten über ihren tiefen Eingriff in die Entwicklung des kindlichen Immunsystems die Entwicklung autistischer Krankheitsbilder fördern (Richmand 2011).
-
Seit 2010 ist in D der polyvalente Konjugatimpfstoff Menveo(TM) zugelassen, der - an Diphtherietoxoid konjugiert - Erregegerbestandteile der Meningokokkengruppen A, C, W und Y enthält. Er wird von der STIKO empfohlen als Indikationsimpfstoff bei Reisen in Länder, in denen diese Meningokokkengruppen endemisch vorkommen (z.B. Nordafrika) und für Kinder ab elf Jahren und Erwachsene.
-
Auch hier wurde die Wirksamkeit lediglich über Antikörperspiegelmessungen im Vergleich zu bereits etablierten Produkten anderer Hersteller bestimmt (EMEA 2010, Jackson 2009, Reisinger 2009).
-
Auch die Nebenwirkungen wurden nur im Vergleich mit diesem anderen polyvalenten Konjugatimpfstoff bewertet; sie sind deutlich ausgeprägter als z.B. die eines vergleichbar wirksamen Polysaccharidimpfstoffes, der nach Ansicht z.B. des arznei-telegrammes daher immer noch eine Alternative für die Reiseprophylaxe darstellt (at 2011).
a-t 2006; 37: 100-1
a-t 2011; 42: elektronisch publiziert
Auckland C. J Infect Dis. (2006) 194 (12): 1745-1752. doi: 10.1086/509619
Borrow R. 2010. Clin Vaccine Immunol, 17:154–159
Brigham KS; Curr Opin Pediatr. 2009 Aug;21(4):437-43.
Campbell, H. et al.: Clin. Vaccine Immunol. 2010; 17: 840-7
Campbell, H. Eurosurveillance, Volume 21, Issue 12, 24 March 2016 (Abruf 08.11.2016)
Cutroneo PM. J Child Neurol. 2014 Jan;29(1):128-30. doi: 10.1177/0883073812469724.
Department of Health (UK) et al.: Green Book. Immunisation against infectious disease, Stand Febr. 2011 http://www.dh.gov.uk
EMA: Europ. Beurteilungsbericht (EPAR) MENVEO, Stand Mai 2010 http://www.ema.europa.eu
Ibarz-Pavón, AB: J Infect Dis. 2011 Oct 1;204(7):1046-53.
Jackson, L.A. et al.: Clin. Infect. Dis. 2009; 49: E1-10
Ladhani, SN. Clin Infect Dis. (2015) 60 (4): 578-585. doi: 10.1093/cid/ciu881. Abruf 08.11.2016
Nnadi, C. MMWR Morb Mortal Wkly Rep 2017;66:1352–1356. DOI: http://dx.doi.org/10.15585/mmwr.mm6649a3
Reisinger, K.S. et al.: Clin. Vaccine Immunol. 2009; 16: 1810-5
RKI. EpiBull 43 2016. Abruf 08.11.2016
Richmand BJ. Med Hypotheses. 2011 Dec;77(6):940-7.
Sáfadi MA. Emerg Infect Dis. 2014 May;20(5):806-11. doi: 10.3201/eid2005.130948.
Sidikou F. Lancet Infect Dis. 2016 Nov;16(11):1288-1294. doi: 10.1016/S1473-3099(16)30253-5.
Snape MD. 2005. The Pediatric Infectious Disease Journal. 24(2):128–31
WHO. 2020. The immunological basis for immunization series: module 15: meningococcal disease, update 2020.
WHO. 2011. Meningococcal vaccines: WHo position paper, November 2011. WER 2011, Nr 47.
