In der aktuellen Coronoia überschlagen sich die Medienberichte über tägliche Fortschritte in der Entwicklung von Impfstoffen gegen SARS-CoV-2 - und mantraartig werden Äußerungen von Politikern wiedergekäut Wirksamkeit und Sicherheit der Impfstoff hätten "absolute Priorität" (Superjens Spahn in der ZEIT 15.09.2020). Ein Übersichtsartikel im British Medical Journal weckt Zweifel, ob die laufenden Impfstoffstudien dies überhaupt gewährleisten können (Doshi 2020).
{slider Ziele der Impfstoffentwicklung}
Bei der Entwicklung eines jeden Impfstoffs stehen zwei Ziele im Vordergrund -
-
die Sicherheit eines Impfstoffs, also das Fehlen oder nur sehr seltene Auftreten schwerer Nebenwirkungen oder Impfschäden und
-
seine Wirksamkeit, also das Verhindern der Erkrankung oder zumindest die Verringerung von schweren Verlaufsformen, Komplikationen und Todesfällen.
Gerade der letzte Teilaspekt spielt bei Erkrankungen wie COVID-19, bei denen das ganz überwiegende gros der Infektionen entweder unbemerkt (asymptomatisch) oder als leichter unspezifischer Luftwegsinfekt (subklinisch) und nur ein sehr kleiner Anteil schwer verläuft, eine entscheidende Rolle.
Epidemiologen träumen bei der Wirksamkeit einer Impfung dann zusätzlich vom Verhindern der Weiterverbreitung der Erkrankung ("Herdenimmunität"), etwas, das auch von etablierten Impfstoffen nur die wenigsten in klinisch relevantem Maße leisten (s. hier).
{slider Das Problem der beschleunigten Zulassung}
Es war interessanterweise tatsächlich Bill Gates, der im April 2020 die Weltöffentlichkeit über die angestrebten beschleunigten Zulassungsverfahren bei den COVID-19-Impfstoffen informierte (Gates 2020).
Normalerweise werden in der Impfstoffentwicklung die verschiedenen Phasen der Zulassung jeweils abgeschlossen und ausgewertet, bevor dann die nächste Studienphase beginnt. Das bei COVID-19 angewendete "teleskopierte" Verfahren schiebt diese Phasen zusammen, so wurden z.B. Studien an Menschen schon begonnen, bevor die an Primaten abschließend ausgewertet waren (Haseltine 2020).
Hierzu schreibt der "Arzneimittelbrief", ein industrieunabhängiges Journal, herausgegeben von Mitgliedern der Arzneimittelkommission der Deutschen Ärzteschaft (AkdÄ):
"Die Beschleunigung der Prüfung eines Impfstoffs verkürzt zwangsläufig die Beobachtungszeiträume. Dies birgt Risiken in sich, da insbesondere in der klinischen Phase III, die aus guten Gründen oft Jahre dauert, seltene und verzögert auftretende Impfnebenwirkungen (Reaktogenität) klinisch relevant werden können. Die Teleskopierung birgt auch Risiken zur Einschätzung der klinischen Wirksamkeit der Impfung." (AMB 2020).
Der AMB fährt fort: "Da sich unerwünschte Autoimmunreaktionen und seltene Nebenwirkungen auch zeitlich verzögert zeigen können (15) und die weitere Abklärung von Wechselwirkungen mit z.B. anderen Wirkstoffen bzw. Arzneimitteln, anderen Impfstoffen und Grunderkrankungen im beschleunigten Verfahren nicht mit der erforderlichen Sorgfalt bzw. wissenschaftlichen Gründlichkeit erfolgen kann, ergeben sich aus den bisherigen Daten zur Sicherheit der SARS-CoV-2-Impfstoffe auch weitreichende Probleme hinsichtlich der gesundheitspolitischen Verantwortung bei der Vorsorge."
William Haseltine, ein führender amerikanischer Virologe und Genetiker warnt: „Die Teleskopierung von Testabfolgen und Genehmigungen setzt uns alle einem unnötigen Risiko im Zusammenhang mit der Impfung aus. (...) Schon eine ernste Nebenwirkung pro 1.000 Impfungen bedeutet bei 100 Mio. Menschen für 100.000 einen Schaden, obwohl sie zuvor gesund waren“ (Haseltine 2020).
{slider Will covid-19 vaccines save lives? Current trials aren’t designed to tell us}
Unter dieser Überschrift untersucht der Peter Doshi die im September veröffentlichten Studienprotokolle der vielversprechendsten COVID-19-Impfstoffkandidaten, inwieweit diese rein methodisch überhaupt in der Lage sein werden, die Fragen nach Wirksamkeit und Sicherheit der Impfung relevant zu beantworten - mit ernüchterndem Ergebnis.
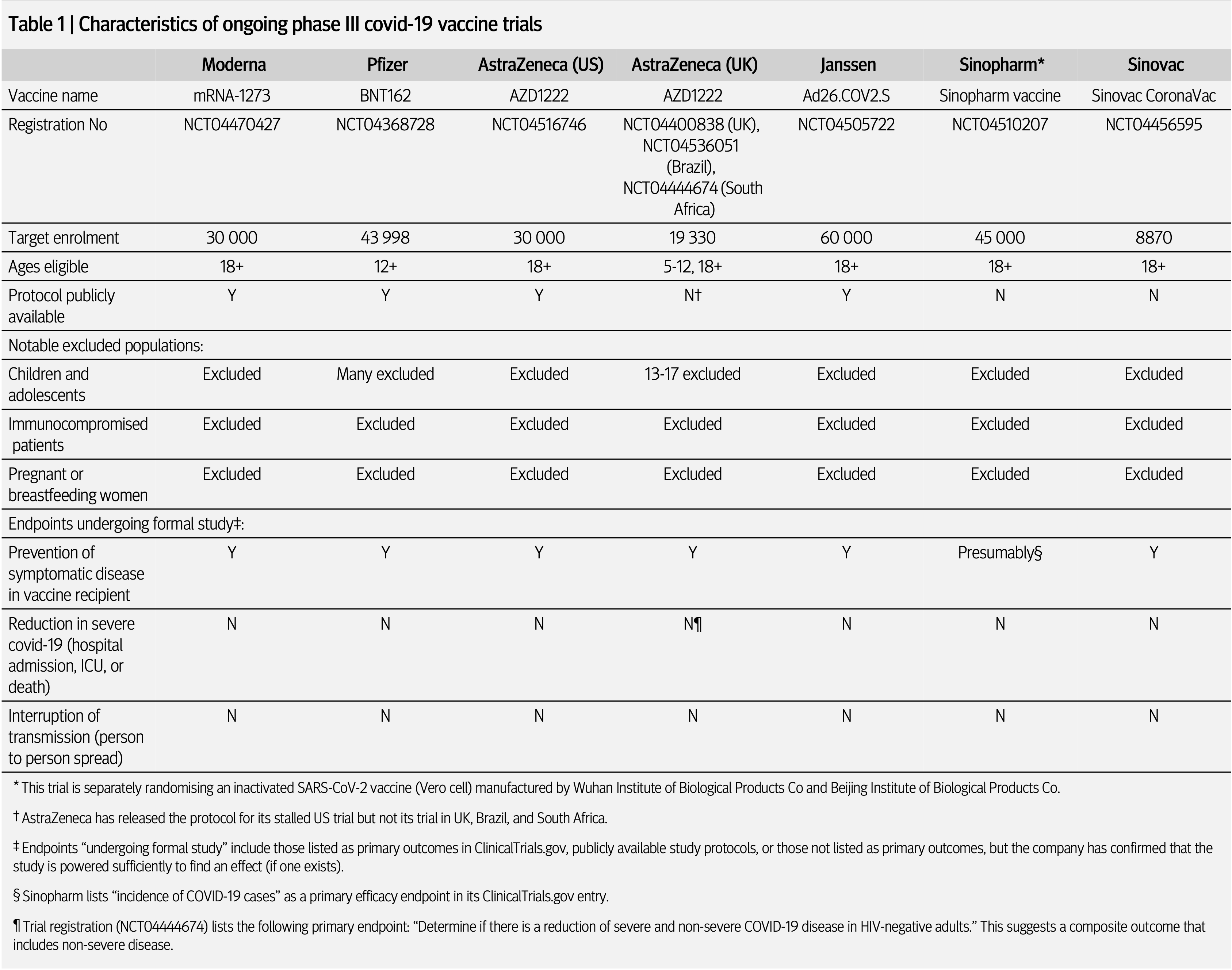
Der Autor liefert im Artikel eine tabellarische Übersicht der aktuell (Ende Oktober 2020) in einer Phase III-Studie befindlichen Kandidaten
(Quelle: Doshi 2020a)
{slider Zur untersuchten Wirksamkeit der COVID-19-Impfstoffkandidaten}
Keine der aktuell laufenden Zulassungsstudien zu COVID-19-Impfstoffen untersucht überhaupt die Verminderung von schweren Verläufen, Krankenhausaufenthalten oder Todesfällen - das jeweilige Studienziel ist bereits mit einer Verringerung PCR-positiver milder Erkrankungen erreicht. Mit anderen Worten: Werden klinisch letztendlich völlig irrelevante leichte Symptome (z.B. nur Husten) mit positivem SARS-CoV-2-PCR-Test (im Studienjargon ist dies ein "Ereignis") in ausreichendem Maße verringert, gilt der Impfstoff als wirksam (Studienprotokolle s. Literatur).
Die Protokolle sehen vor, dass die Studien bereits nach der Dokumentation von 150 - 160 solcher "Ereignisse" beendet werden - ein früheres Ende ist möglich, wenn die Behörden die Wirkung schon vorher als ausreichend nachgewiesen erachten. Damit ist das statistisch auswertbar häufige Auftreten wirklich schwerer Verläufe (und deren Untersuchung in der Studie) praktisch von vorneherein ausgeschlossen. Dies gibt z.B. der Chief Medical Officer von Moderna, Tal Zaks, dem BMJ gegenüber auch offen zu: zum Untersuchen der (letztendlich einzig relevanten) schweren Verläufe fehlt den Studie die statistische Aussagekraft: "The trial is precluded from judging [hospital admissions], based on what is a reasonable size and duration to serve the public good here" (Doshi 2020).
Und: auch wenn zwei Studien Kinder mit einschließen und in allen auch ältere Probanden vertreten sind, wird nach Einschätzung des BMJ deren kleine Zahl in keiner der Studien eine Aussage zur Wirksamkeit in diesen "Randgruppen" erlauben - was speziell bei COVID-19 mit der eindeutigen Risikogruppe Älterer den Wert und die Aussagekraft der Untersuchungen weiter kompromittiert. Paul Offit, einer der renommiertesten Impfologen der Welt folgert daraus im sehr lesenswerten Interview mit Medscape “If we don’t have adequate data in the greater than 65 year old group, then the greater than 65 year old person shouldn’t get this vaccine, which would be a shame because they’re the ones who are most likely to die
from this infection. […] You can’t convince minority populations to get this vaccine unless they are represented in these trials. Otherwise, they’re going to feel like they’re guinea pigs, and understandably so.” (Topol 2020).
Der Arzneimittelbrief weist darauf hin, dass es bei einer Erkrankung, die bei Unter-70-Jährigen eine Sterblichkeit (Infektionssterblichkeitsrate IFR) von lediglich etwa 0,05% (Ioannidis 2020), "sehr schwer" werde, in dieser Gruppe überhaupt einen Nutzen der Impfung nachzuweisen.
Fü die Über-70-Jährigen fürchtet der AMB könne der Impfstoff gar keine Zulassung erhalten, da diese - wie schon beschrieben - in den Zulassungsstudien nicht ausreichend repräsentiert seien.
In diesem Sinne warnt Peter Doshi in einem zweiten Artikel im BMJ davor, die Euphorie zu den Impfstoffen auf die bisher angegebenen Wirksamkeiten ("90%, 95%, ...") zu gründen - diese gäben relative Risikoverminderungen an (also Angaben nur im Vergleich der Studienpopulation) - die entscheidende Verminderung des absoluten Risikos der Normalbevölkerung (dies ist die eigentlich relevante Größe, da sie das Risiko, sich überhaupt zu infizieren, mit berücksichtigt) nimmt er mit unter 1% an (in Worten: weniger als ein Prozent) (Doshi 2020b).
Und auch der zweite bei einer Pandemie wie COVID-19 entscheidende Punkt bleibt in den Studien ungeklärt: "Our trial will not demonstrate prevention of transmission" so Zaks weiter - die Frage, ob eine Weiterverbreitung der Infektion durch die Impfung unterbunden oder zumindest verringert wird (die Herdenimmunität), wird gar nicht erst untersucht.
Dies kritisiert auch der AMB und weist darauf hin, dass zumindest für den AstraZeneca-Impfstoff die notwendige "sterile Immunität", also der Schutz des Geimpften und das Verhindern der Weiterverbreitung, in den Tierversuchen definitiv nicht erreicht wurde: die verwendeten Rhesusaffen wiesen auch nach der Impfung, die sie selber vor der Erkrankung schützte, die gleiche Viruslast vermehrungsfähiger Viren im Nasen-Rachen-Raum auf, wie ungeimpfte Tiere (Doremalen 2020). Die bisher veröffentlichten Studienergebnisse, so der AMB, ließen keine Herdenimmunität erwarten.
{slider Zur untersuchten Sicherheit der COVID-19-Impfstoffkandidaten}
Gerade die Tatsache, dass die Studien ohnehin nur die Dokumentation von 150 - 160 "Ereignissen" (also z.B. Menschen mit Husten und positiver PCR...) fordern und dann noch abgekürzt werden können, wenn dies den Zulassungsbehörden probat scheint, verhindert das Aufdecken seltener, schwerer Nebenwirkungen vor der Zulassung hocheffektiv:
Um zu beweisen, dass eine Gesundheitsstörung, die in der Bevölkerung normalerweise einen von zehntausend Menschen betrifft, nach der Impfung doppelt so häufig auftritt, bräuchte es Studien von 360.000 Teilnehmern (s. hier) ... mit entsprechend langer Laufzeit... .
Arzneimittelexperten der Universität Harvard schließen daher folgerichtig: “Finding severe rare adverse events will require the study of tens of thousands of patients, but this requirement will not be met by early adoption of a product that has not completed its full trial evaluation” (Avorn 2020). Genau dies: die Zulassung vor dem Vollenden der vollständigen Studienauswertung wird derzeit aber durch das so genannte Rolling Review Verfahren der europäischen Arzneimittelbehörde EMA möglich.
Die bisher vorliegenden Daten der Zulassungsstudien sind ernüchternd:
Der AstraZeneca-Impfstoffkandidat führte in den PhasenI/II zu einer signifikant höheren Rate von Nebenwirkungen, obwohl er dort nicht gegen Plazebo, sondern gegen (bekanntermaßen nicht optimal verträgliche) Meningikokkenimpfstoffe getestet wurde (AMB 2020). In der Phase III traten dann zwei Fälle einer schweren neurologischen Komplikation ("transverse Myelitis") auf - die auffallende, nennen wir es: Zurückhaltung, mit der AstraZeneca bis heute über diese Vorfälle "informiert", war dem renommierten Wissenschaftsjournal Nature einen eigenen Artikel wert (Mallapaty 2020).
Der BioNTech/Pfizer-Impfstoffkandidat führte bei fast 4% der Geimpften zu einer schweren Erschöpfung und bei 2% zu starken Kopfschmerzen - eingeschätzt jeweils als "grade 3-Nebenwirkung", die durch ihre Schwere übliche tägliche Aktivitäten verhinder (Doshi 2020b). Nach der ersten Impfung kam es bei 5 von 11 Untersuchten zu einer (in einem Fall schweren) Verminderung weißer Blutkörperchen im Blut (AMB 2020).
Bei Modernas Impfstoffkandidat war der gleich Effekt (grade 3) bei 9% der Geimpften durch Erschöpfung und bei 10% durch Muskelschmerzen bedingt (Doshi 2020b).
Langfristiges
Gerade weil AstraZeneca für seinen Vektor-Virus-Impfstoff einen DNA-Virus als Vektor wählte, bleiben grundsätzliche Befürchtungen, dass Teile der viralen DNA in die Erbinformation der Geimpften eingebaut werden könnte. Dies könnte erhebliche Risiken z.B. der Tumorentstehung bedeuten (AMB 2020), die naturgemäß erst in Nachbeobachtungszeiträumen, die viele Jahre betragen, auffallen können (Vogel 2020). Der Arzneimittelbrief nennt daher gerade bei dieser Impfstofftechnologie die Verkürzung der Zulassungsverfahren "besonders problematisch".
Angesichts der hochnotwendigen Langzeitbeobachtung dieser neuen Impfstofftechnologien irritiert besonders, dass die ersten Hersteller vorbereiten, die Plazebo-Gruppen der Zulassungsstudien - angesichts der überragenden Wirksamkeit der Impfstoffkandidaten natürlich aus rein ethischen Gründen - mit dem "Verum", also dem eigentlichen Impfstoff, nachzuimpfen. Diese - von der Zulassung der HPV-Impfung bekannte - Strategie verhindert den so unerlässlichen Langzeitvergleich Geimpfter und nur Schein-Geimpfter ein für alle Mal (Cyranoski 2020).
{slider Zusammenfassung}
Die mit beispiellosem finanziellen Aufwand betriebenen, mit einzigartiger medialer Dauerbeschallung begleiteten, mit messianischen Heilserwartungen geschmückten Studien zu den COVID-19-Impfstoffkandidaten werden - auch wenn sie im Sinne der Behörden und der Hersteller (!) "erfolgreich" abgeschlossen werden und zur Zulassung eines oder mehrerer COVID-19-Impfstoffe(s) führen - die wesentlichen Antworten schuldig bleiben:
-
wir werden nicht wissen, wie gut diese Impfstoffe schwere COVID-19-Verläufe verringern
-
wir werden nicht wissen, wie gut dieser Schutz bei der Haupt-Zielgruppe der Impfung, den Älteren, trägt
-
wir werden nicht wissen, welche schweren Nebenwirkungen wie häufig zu erwarten sind.
{slider Literatur}
AMB. 2020. Der Arzneimittelbrief 54, 85
AstraZeneca. Clinical Study Protocol - Amendment 2 AZD1222- D8110C00001. 2020. https://s3.amazonaws.com/ctr-med-7111/D8110C00001/52bec400-80f6-4c1b-8791- 0483923d0867/c8070a4e-6a9d-46f9-8c32-cece903592b9/D8110C00001_CSP-v2.pdf.
Avorn J. 2020. Regulatory decision-making on covid-19 vaccines during a public health emergency. JAMA. doi:10.1001/jama.2020.17101.
Cyranoski D. 2020. https://www.nature.com/articles/d41586-020-03219-y
van Doremalen, N. 2020. Nature 586, 578.
Doshi P. 2020a. BMJ 371:m4037; doi: 10.1136/bmj.m4037. Abruf 23.10.2020
Doshi P. 2020b. https://blogs.bmj.com/bmj/2020/11/26/peter-doshi-pfizer-and-modernas-95-effective-vaccines-lets-be-cautious-and-first-see-the-full-data/
Gates B. 2020. https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccineyou-need-to-know-about-the-COVID-19-vaccine
Haseltine. WA. 2020.Scientific American. https://www.scientificamerican.com/article/the-risks-of-rushing-a-covid-19-vaccine/
Ioannidis, J.P.A.: https://www.who.int/bulletin/online_first/BLT.20.265892.pdf
Janssen Vaccines & Prevention BV. VAC31518 (JNJ-78436735) clinical protocol VAC31518COV3001 amendment 1. 2020. https://www.jnj.com/coronavirus/covid-19-phase-3-study-clinical-protocol.
Mallapaty S. 2020. https://www.nature.com/articles/d41586-020-02706-6
Moderna TX. 2020. Protocol mRNA-1273-P301, Amendment 3. 2020. https://www.modernatx.com/sites/default/files/mRNA-1273-P301-Protocol.pdf.
Pfizer. 2020. PF-07302048 (BNT162 RNA-Based COVID-19 Vaccines) Protocol C4591001. https://pfe-pfizercom-d8-prod.s3.amazonaws.com/2020-09/C4591001_Clinical_Protocol.pdf
Topol EJ. 2020. Paul Offit’s biggest concern about covid vaccines. https://www.medscape.com/viewarticle/936937scape.com/viewarticle/936937.
Vogel PUB. 2020. COVID-19: Suche nach einem Impfstoff. Springer Spektrum 2020, Wiesbaden, S. 24. https://www.springer.com/de/book/9783658313395
ZEIT. 15.09.2020. "Es geht nicht darum, die Ersten zu sein". Abruf 23.10.2020
{/sliders}